Задачи по ОХТ (онлайн) решения часть 4
Задача И-113 Вычислить теоретический расходный коэффициент для ацетилена и выход ацетальдегида при получении 1 т ацетальдегида, если степень превращения ацетилена 50 мас.д., выход в расчете на прореагировавший ацетилен 90 мас.д., практический расход ацетилена 680 кг на 1 т ацетальдегида.
C2H2 + H2O = CH3-CHO
Скачать решение задачи И-113 (цена 100р)
Задача И-114 Рассчитать расходные коэффициенты Zn и 98% Н2SО4 для получения гидроксида цинка, если степень превращения серной кислоты 79%, выход сульфата цинка 86% от теоретически возможного, а выход готового продукта 91% от теоретически возможного. Расчет вести на 597 кг гидроксида.
Скачать решение задачи И-114 (цена 100р)
Задача И-115 Определить объем оксида углерода(II), выделившегося при обжиге известняка, содержащего 10% примесей. Расход известняка 500 тонн. Степень превращения 86%.
CaCO3 → CaO + CO2
Скачать решение задачи И-115 (цена 100р)
Задача И-116 Составить материальный баланс производства 8т ацетилена из карбида кальция следующего состава (%масс.):
- СаС2 – 83%;
- СаО – 14%;
- С – 3%.
Степень превращения карбида кальция составляет 81%.
CaC2 + 2H2O → Ca(OH)2 + C2H2
Скачать решение задачи И-116 (цена 100р)
Задача И-117 Определить часовой расход ангидрита, содержащего 86,8% CaSO4 при переработке его в серную кислоту в цехе мощностью 150.000 т моногидрата в год. Количество рабочих дней в году 350, коэффициент использования серы во всем процессе – 90%.
Скачать решение задачи И-117 (цена 100р)
Задача И-118 Рассчитать расходные коэффициенты и массовый состав воздуха (О2 –21%, N2 – 79%) и аммиака следующего состава: NН3 – 17%, N2 – 11%, Н2 –72%, в производстве азотной кислоты, если в реакцию вступает 97% аммиака, выход NО составляет 77% от теоретически возможного, а выход готового продукта 17%. Расчет вести на 1572 кг азотной кислоты.
Скачать решение задачи И-118 (цена 100р)
Задача И-119 Определить расходный коэффициент раствора, содержащего 10% NаОН, необходимого для нейтрализации Н2SО4. Степень превращения щелочи 58%. Расчет вести на 7,3 тонн Nа2SO4.
Скачать решение задачи И-119 (цена 100р)
Задача И-120 Составить материальный баланс производства 5,5 т ацетилена из природного газа следующего состава (% об.):
– СН4 – 93%;
– С2Н6 – 4%;
– С3Н8 – 1%;
– N2 – 2%.
Степень превращения метана составляет 85%.
Скачать решение задачи И-120 (цена 100р)
Задача И-121 Определить количество моногидрата в сборнике. Вертикальный цилиндрический сборник диаметром 3 м заполнен на 1,5 м 92 %-ной серной кислотой. Плотность 92 %-ной кислоты при 20 °С 1824 кг/м3.
Скачать решение задачи И-121 (цена 100р)
Задача И-122 Рассчитать расход пирита, содержащего 78% FeS2, и воздуха (О2 – 21%, N2 – 79%) в производстве 540 кг серной кислоты. Выход SО2 15% от теоретически возможного, Степень превращения SО3 – 50%, а выход готового продукта 70% от теоретически возможного.
Скачать решение задачи И-122 (цена 100р)
Задача И-123 Определить расходный коэффициенты аммиака и азотной кислоты для получения 5 тонн нитрата аммония, если степень превращения аммиака составляет 49%, а выход готового продукта 74% от теоретически возможного.
HNO3 + NH3 → NH4NO3 + Q
Скачать решение задачи И-123 (цена 100р)
Задача И-124 Определить состав газа, получаемого при сжигании сероводородного газа, содержащего 85% H2S и 4% (об.) Н2О. Количество воздуха, подаваемого в горелку, равно десятикратному объему газа. Воздух содержит 1,5% (об.) Н2О.
Скачать решение задачи И-124 (цена 100р)
Задача И-125 Рассчитать расход водяного пара и природного газа, содержащего 76% метана, в производстве 1470 кг аммиака. Степень превращения СН4 – 81%, выход водорода составляет 70% от теоретически возможного, а выход готового продукта 81% от теоретически возможного.
Скачать решение задачи И-125 (цена 100р)
Задача И-126 Определить расходный коэффициент 10%-ной Н2SO4, необходимой для реакции нейтрализации NaOH. Степень превращения серной кислоты 71%. Расчет вести на 1 тонну Nа2SO4.
2NaOH + H2SO4 → 2H2O + Na2SO4
Скачать решение задачи И-126 (цена 100р)
Задача И-127 Составить материальный баланс реактора каталитического окисления метанола в формальдегид. Содержание метанола в спирто-воздушной смеси 15% об. Степень превращения метанола 70%. Расчет вести на 1,5 т готового продукта.
2CH3OH + O2 → 2HCHO + 2H2O
Скачать решение задачи И-127 (цена 100р)
Задача И-128 Подсчитать максимальное содержание двуокиси серы в обжиговом газе, полученном при сжигании колчедана, при условии, что весь кислород поступающего в печь воздуха расходуется на обжиг.
Скачать решение задачи И-128 (цена 100р)
Задача И-129 Рассчитать расходные коэффициенты воздуха (О2 –21%, N2 – 79%) и природного газа следующего состава: СН4 – 98%, N2 – 2%, в производстве метанола следующего состава: СН3ОН – 93%, Н2О – 6%, примеси 1%, если степень конверсии метана составляет 87%, выход метанола 15% от теоретически возможного.
NH4 + 0,5O2 → CH3OH
Скачать решение задачи И-129 (цена 100р)
Задача И-130 Рассчитать объёмный расход аммиака с объёмной долей основного вещества 99,9% для получения 15 т/ч азотной кислоты концентрацией 55%. Степень использования сырья 0,8.
Скачать решение задачи И-130 (цена 100р)
Задача И-131 Составить материальный баланс разложения фосфорита серной кислотой
Состав фосфорита,кг: Ca3(PO4)2 - 1400; CaF2 - 45; неразлагаемые примеси - 80; влага - 37%. Степень разложения фосфорита 88%. Концентрация серной кислоты, 73%.
Скачать решение задачи И-131 (цена 100р)
Задача И-132 Составить материальный баланс стадии алкилирования бензола этиленом на 1500кг чистого этилбензола, если выход этилбензола составляет 65%. Известно также, что в результате побочных реакции на каждую тонну этилбензола образуется 50кг диэтилбензола и 20 кг триэтилбензола. Реагенты берутся в стехиометрическом соотношении по реакции №1. Исходный бензол содержит 2%об этана, а этилен -5%об этана.
C6H6 + C2H4 → C6H5C2H5
C6H6 + 2C2H4 → C6H4(C2H5)2
C6H6 + 3C2H4 → C6H3(C2H5)3
Скачать решение задачи И-132 (цена 100р)
Задача И-133 Составить материальный баланс реактора алкилирования бензола этан-этиленовой фракцией состава: C2H4 -50%, C2H6 - 45%, C3H6 - 1%, C3H8 - 4%.
Производительность реактора 15т этилбензола в час. конверсия этилена-0,95, пропилена -0,98, селективность образования этилбензола (ЭБ) -0,9, изопропилбензола (ИПБ) – 0,85. Мольное соотношение C6H6/C2H4 = 3. Побочные реакции –образование диалкилбензолов (диэтилбензола (ДЭБ) и диизопропилбензола (ДИПБ)). Реагенты берутся в стехиометрическом соотношении по реакции №1. Исходный бензол содержит 2%об этана, а этилен -5%об этана.
C6H6 + C2H4 → C6H5C2H5
C6H6 + C3H6 → C6H5CH(CH3)2
C6H6 + 2C2H4 → C6H4(C2H5)2
C6H6 + 2C3H6 → C6H4(CH(CH3)2)2
Скачать решение задачи И-133 (цена 100р)
Задача И-134 Рассчитать расходные коэффициенты ацетилена и водородного газа следующего состава: Н – 96%; О – 0,91%; N – 3,09%, для получения 4 тонн бензола, если степень превращения ацетилена составляет 72%, выход этилена 61% от теоретически возможного, а выход готового продукта 73% от теоретически возможного.
Химическая схема процесса:
4C2H2 + H2 → C6H6 + C2H4
Скачать решение задачи И-134 (цена 100р)
Задача И-135 Рассчитать теплоту, выделяемую при протекании экзотермической реакции разложения 1 т апатитового концентрата. Коэффициент разложения 97%. Содержание фторапатита в апатитовом концентрате 98%. Энтальпия образования веществ, кДж/моль:
Ca5F(PO4)3 - 6828,7; H2SO4 - 839,5; H2O - 286,4; CaSO4*2H2O - 2022,6; H3PO4 - 1278,2; HF - 269,6.
Скачать решение задачи И-135 (цена 100р)
Задача И-136 Рассчитать материальный баланс реактора для приведенной выше реакции при следующих условиях: ПNH3 = 5кг/ч, XNH3 = 0,95; XN2 = 0,8; ф(N2)NH3 - 0,9; ф(H2)NH3 - 0,97.
Скачать решение задачи И-136 (цена 100р)
Задача И-137 Составить материальный баланс контактного узла окисления аммиака в производстве азотной кислоты. Количество окисляемого аммиака,1750 кг. Степень окисления аммиака до NO2 - 95,9%, од N2 - 4,1%. Содержание в аммиачно-воздушной смеси аммиака 12 %об
4NH3 + 5O2 ↔ 4NO + 6H2O
4NH3 + 3O2 ↔ 2N2 + 6H2O
Скачать решение задачи И-137 (цена 100р)
Задача И-138 Составить материальный баланс (в килограммах) окисления аммиака на 1 т аммиака, предполагая, что оксиление полное. 2% аммиака окисляется только до азота. Аммиачно-воздушная смесь с объемной долей аммиака 0,11.
Уравнение реакций:
4NH3 + 5O2 ↔ 4NO + 6H2O
4NH3 + 3O2 ↔ 2N2 + 6H2O
Скачать решение задачи И-138 (цена 100р)
Задача И-139 Составить уравнения материального баланса для ХТС конверсии метана водяным паром с целью получения стехиометрической азотно-водородной смеси для синтеза аммиака. Объем метана, подаваемого на конверсию V - 10000 м3, мольное соотношение метана и водяного пара 1:2.
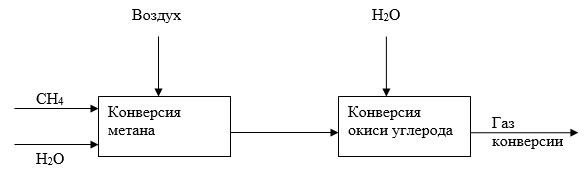
Скачать решение задачи И-139 (цена 100р)
Задача И-140 Производительность установки одностадийного дегидрирования н-бутана составляет 3400 кг бутидиена в час. Определить объем контактной массы, если объемная скорость паров н-бутана составляет 300 ч -1, объемное отношение катализатора и теплоносителя равно 1:2,4, степень конверсии н-бутана 30%, а селективностъ по бутадиену 55%.
Скачать решение задачи И-140 (цена 100р)
Задача И-141 Составить материальный баланс процесса паровой конверсии монооксида углерода (на 1000нм3 сухого концентрированного газа). Состав концентрированного газа
CO - 5%, CO2 - 17%, H2 - 58%, CH4 - 1%, N2 - 19% пар/газ - 0,7. Ост.конц. СО (СГ),0,5 %об.
Скачать решение задачи И-141 (цена 100р)
Задача И-142 Составить тепловой баланс по получению 1000 м3 Н2 конверсией метана в одну стадию при 1000 °С:
CH4(г) + H2O(п) = CO(щ) + 3H2(г), H>0
Скачать решение задачи И-142 (цена 100р)
Задача И-143 Рассчитать физическую теплоту газового потока в (МДж) на входе в конденсатор высокого давления. Поток имеет следующий состав, кг: СО2 - 62080; NH3 - 41605; Н2О - 3340; N2 - 1150; О2 - 224, и температуру 190 °С. Значения теплоемкостей рассчитать по эмпирическим формулам или взять из справочных таблиц.
Скачать решение задачи И-143 (цена 100р)
Задача И-144 Составить тепловой баланс сжигания серы в печи производительностью 3000 кг/ч по сере, степень окисления серы - 0,95. Коэффициент избытка воздуха 1,3. Температуры веществ, °С: сера - 140, воздух - 90. Потери тепла в окружающую среду составляют 10 % от прихода. Теплоемкость серы 1,037 кДж/(кг·К), теплоемкость воздуха 1,285 кДж/(м3·К). ΔНреак = -296,9 кДж/моль.
Скачать решение задачи И-144 (цена 100р)
Задача И-145 Определить равновесный состав (Па) газа при синтезе СН3ОН при соотношении Н2:СО 4,5:1 (в циркуляционном газе). Содержание инертных примесей - 13,8 %; давление 30 МПа, температура 365 °С. Температурная зависимость константы равновесия:
lgKp = lgPCH3OH*/(PCO**PH2*)-9,81*lgT - 0,00347*T+14,8
Скачать решение задачи И-145 (цена 100р)
Задача И-146 Рассчитать теплоту, выделяющуюся при сгорании 1 м3 топливного природного газа следующего состава: СН4 - 92; С2Н6 - 3; С3Н8 - 2; N2 - 3. Значения энтальпий образования веществ взять из справочных таблиц.
Скачать решение задачи И-146 (цена 100р)
Задача И-147 Составить тепловой баланс стадии контактирования при получении 1 т 100 %-ной НNО3. Содержание аммиака в АВС - 10,5 об. %. Степень контактного окисления - 97 %. Степень окисления NО - 100 %. Степень абсорбции - 98 %. Воздух насыщен парами воды при 30 °С. Относительная влажность - 80 %. Температура, °С: АВС - 405, НГ - 800. Теплота экзотермических реакций, кДж/кмоль: при окислении NН3 до NО - 918·103; при окислении NН3 до N2 - 1285*103.
Скачать решение задачи И-147 (цена 100р)
Задача И-148 Процесс окисления моноокида азота до диоксида азота сопровождается образованием димера N2О4. Рассчитать степень полимеризации NО2 для газовой смеси содержащей 5 об. % NО2 в исходном газе, если давление газа составляет 0,1 МПа, а температуры - 40 °С. Значение константы равновесия:
Kp=PNO2*2/PN2O4
Скачать решение задачи И-148 (цена 100р)
Задача И-149 При 727°С константа равновесия реакции 2SO3 = 2SO2 + O2 Kp = 2,93*104 Па. Под каким давлением степень диссоциации SO3 составит 20%

Скачать решение задачи И-149 (цена 100р)
Задача И-150 Для реакции 2HI = H2 + I2 при 360°С и 1,013•105 Па а = 20%. Определите, в каком направлении будет протекать процесс при следующих значениях парциальных давлений реагирующих веществ:
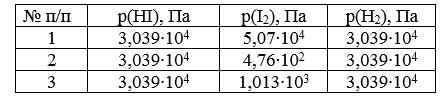
Скачать решение задачи И-150 (цена 100р)
Задача И-151 Рассчитать материальный баланс аммиачной селитры
Основное химическое уравнение :
NH3 + НNO3 → NH4NO3 + Q
Производительность установки по готовому продукту (100% NН4NО3) 2500 кг/ч/ Состав поступающего сырья, %масс
- азотная кислота - 60
- аммиак - 100
Содержание нитрата аммония в готовом продукте 99 %масс
Потери, %масс
- аммиака -0,5
- азотной кислоты - 0,5
Скачать решение задачи И-151 (цена 100р)
Задача И-151-1 Рассчитать материальный баланс аммиачной селитры
Основное химическое уравнение : NH3 + НNO3 → NH4NO3 + Q
Производительность установки
по готовому продукту (100% NН4NО3), 1000кг/ч
Состав поступающего сырья, %масс
- азотная кислота 48
- аммиак 97
Содержание нитрата аммония в готовом продукте, 66 %масс
Потери от выхода NН4NО3, %масс
- аммиака 0,3
- азотной кислоты 0,75
Скачать решение задачи И-151-1 (цена 100р)
Задача И-152 Составить материальный баланс для метилпреднизолона на 10 тонн. 6-a-метилкортизон подвергают микробиологическому дегидрированию по положению с получением метилпреднизолона:
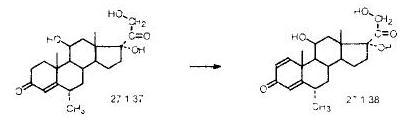
Запишем уравнение реакции следующим образом: C22H32O5 = C22H30O5 + H2
Скачать решение задачи И-152 (цена 100р)
Задача И-153 Материальный баланс производства тиамина (витамина В1)
Синтез тиамина из пиримидинового и тиазолового компонентов согласно реакции:
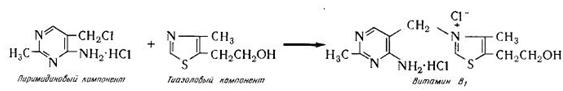
Производительность тиамина 10т=10000кг. Запишем реакцию по эмпирическим формулам компонентов:
C6H9N3Cl2 + C6H9OSN = C12H17N4OSCl2
Скачать решение задачи И-153 (цена 100р)
Задача И-154 Составить материальный баланс обжига железного колчедана (FeS2), содержащего различные примеси, включая 4,6% воды, если массовая доля серы в колчедане 42%. Считать, что обжиг ведут чистым кислородом с 10%-ным избытком от теоретического. расчет вести на 1 т колчедана, найти невязку баланса. Уравнение процесса:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Скачать решение задачи И-154 (цена 100р)
Задача И-155 Рассчитать материальный баланс производства хлора методом электролиза водного раствора хлорида натрия:
2NaCl + 2H2O = 2NaOH + Cl2 + H2
Концентрация NaCl в растворе 310г/л. плотность раствора при условиях электролиза 1,17кг/л. степень разложения 50%. Побочные процессы в расчет не принимать. расчет вести на 1000 м3 хлора
Скачать решение задачи И-155 (цена 100р)
Задача И-156 Рассчитать материальный баланс производства 15000т/ч 87%-ной серной кислоты из серного колчедана, содержащего 44% серы, при условии, что степень выгорания серы в колчедане составляет 99%, степень каталитического окисления диоксида серы -89,3%, а степень абсорбции триоксида серы -99,5%. Обжиговый газ содержит 12% диоксида серы. Воздух влажностью 50% перед подачей в печь для обжига колчедана подвергается осушке получаемой серной кислотой.
Скачать решение задачи И-156 (цена 100р)
Задача И-157 Рассчитать физическую теплоту 1 м3 топливного природного газа следующего состава, об. %: СН4 - 90; С2Н6 - 5; С3Н8 - 2,5; N2 - 2,5. Температура топливного природного газа равна 50 °С. Значения теплоемкостей рассчитать по эмпирическим формулам или взять из справочных величин.
Скачать решение задачи И-157 (цена 100р)
Задача И-158 В реактор окисления NН3 поступает АВС с расходом 60000 м3/ч (при н.у.), содержащая 10 об. %NН3. Селективность по NО составляет 0,95 при полном превращении NН3. Побочный продукт N2. Реакции:
4NH3 + 5O2 = 4NO + 6H2O; ΔН = -908 кДж (1)
4NH3 + 3O2 = 2N2 + 6H2O; ΔН = -1270 кДж (2)
Теплоемкости кДж/(моль·К): NH3 -38,5; O2 - 30,2; N2 - 29,2; NO - 31,9; H2O - 38,0. Температура в реакторе 1150 К. Потери тепла в окружающую среду составляют 10 % от прихода. Определить температуру на входе в реактор.
Скачать решение задачи И-158 (цена 100р)
Задача И-159 Газовая смесь, состава % объемных: СО - 20%, N2 - 80%, пропускается при температуре 1000 С и давлении 0,1 МПа над оксидом железа (II). В соответствии с реакцией:
FеО + СО = Fе + СO2.
Определить массу образовавшегося Fе на 1000 м3 исходного газа, состав равновесного газа, если константа равновесия равна 0,403.
Скачать решение задачи И-159 (цена 100р)
Задача И-160 Негашенная известь содержит 92% CaO, 3,5% CO2 и 4,5% примесей. Получается она обжигом известняка, содержащего 89% CaCO3*CO2 в негашенной извести получается из-за наличия в ней карбонатов, количество которых определяет степень обжига известняка. Определить расходный коэффициент известняка на 1 т извести указанного состава и степень обжига известняка (% массовые).
Скачать решение задачи И-160 (цена 100р)
Задача И-161 Составить материальный баланс и рассчитать выход при обжиге 1000кг руды, содержащей 22% массовых долей серы в виде сульфида цинка (остальное –несгораемые примеси) и при подаче полуторакратного избытка воздуха по отношению к стехиометрии. Реакция обжига
2ZnS + 3O2 = 2ZnO + 2SO2
В огарке содержится 0,5% массовых долей серы.
Скачать решение задачи И-161 (цена 100р)
Задача И-162 Составить материальный баланс синтеза фенолоформальдегидного олигомера (ФФО) из фенола чистотой 98% и формалина (36% формальдегида в воде) на годовую производительность 1000 тонн в год при конверсии по фенолу 90%. Молярное соотношение (загрузочное) фенол:формальдегид = 5:7.
Скачать решение задачи И-162 (цена 100р)
Задача И-163 Определить объем реакторов из расчета, что их будет 3 штуки, если время цикла процесса 9 часов. Эффективный фонд рабочего времени реактора составляет 7200 ч/год, плотность реакционной массы 1100 кг/м3, коэффициент заполнения реактора 0,75, коэффициент запаса мощности 1,1
Скачать решение задачи И-163 (цена 100р)
Задача И-164 Составить материальный баланс производства уксусной кислоты окислением ацетальдегида кислородом воздуха и рассчитать технологические показатели производства. Процесс окисления ацетальдегида в уксусную кислоту осуществляется в аппарате колонного типа при температуре 75С в присутствии солей и металлов переменной валентности, при этом протекают следующие реакции:
CH3-CHO + 0,5O2 → CH3-CHOOH
3CH3-CHO + 3O2 → 2CH3-CHOOH + HCOOH + H2O + CO2
2CH3-CHO + 5O2 → 4H2O + 4CO2
Составим систему уравнений:
A + 0,5B = C
3A + 3B = T + C + M + K
2F + 5B = 4M + 4K
Производительность по ледяной кислоте 86,9% -ной концентрации 1700кг/ч.
Скачать решение задачи И-164 (цена 100р)
Задача И-165 Составить материальный баланс газификации 1 т кокса, идущей по реакциям:
C + H2O = CO + H2 - 131кДж
CO + H2O = CO2 + H2 + 42131 кДж
В коксе содержится 3масс% зольных примесей, массовое содержание пар: кокс = 1,5, степень превращения углерода в коксе -0,87, выход моноксида углерода в коксе -0,7. Найти также общее количество подведенной теплоты.
Скачать решение задачи И-165 (цена 100р)
Задача И-166 Рассчитать материальный баланс печи окислительного обжига в производстве ванадата натрия NaVO3 в расчете на 1т готового продукта.
уравнения реакций:
2NaCl + 0,5O2 = Na2O + Cl2
Na2O+ V2O5 = 2NaVO3.
Суммарная реакция:
2NaCl + 0,5O2 + V2O5 = 2NaVO3 + Cl2
Сырье: ванадиевый шлак, содержащий 0,13%(масс.) V2O5, а в реакцию вступает весь кислород, 70% всего хлорида натрия и 95% всего V2O5. Определить невязку баланса.
Скачать решение задачи И-166 (цена 100р)
Задача И-167 Рассчитать расходные коэффициенты и массовый состав воздуха (О2 –21%, N2 – 79%) и аммиака следующего состава: NН3– 17%, N2 – 11%, Н2 –72%, в производстве азотной кислоты, если в реакцию вступает 97% аммиака, выход NО составляет 77% от теоретически возможного, а выход готового продукта 17%. Расчет вести на 1572кг азотной кислоты.
Скачать решение задачи И-167 (цена 100р)
Задача И-168 Определить расходный коэффициент раствора, содержащего 10% NаОН, необходимого для нейтрализации Н2SО4. Степень превращения щелочи 58%. Расчет вести на 7,3 тонн Nа2SO4.
Скачать решение задачи И-168 (цена 100р)
Задача И-169 Составить материальный баланс производства 5,5т ацетилена из природного газа следующего состава (% об.):
СН4 – 93%; С2Н6 – 4%; С3Н8 – 1%; N2 – 2%.
Степень превращения метана составляет 85%.
Скачать решение задачи И-169 (цена 100р)
Задача И-170 Определить количество моногидрата в сборнике. Вертикальный цилиндрический сборник диаметром 3 м заполнен на 1,5 м 92 %-ной серной кислотой. Плотность 92 %-ной кислоты при 20 °С 1824 кг/м3.
Скачать решение задачи И-170 (цена 100р)
