Задачи по реакторам разные
Задача 1-1 (ОХТ реактора раз.) Дана обратимая реакция А ↔ R, имеющая константу скорости k1=1,75*10-3 с-1. Начальные концентрации исходного вещества СА0 = 0,45 кмоль*м-3, продукта СR = 0. Константа равновесия Кс = 4,8. Цена вещества А в пересчете на 1 кмоль 5,6 руб (кмоль А)-1. Объем реактора смешения V= 1,4 м3, производственные затраты на его обслуживание 6,2•10-3 руб*с-1*м-3. Объем реактора вытеснения 1,4 м3, производственные затраты на его обслуживание 8,0•10-3 руб•с-1•м-3.
После реактора проводится разделение продукта и непрореагировавшего вещества А, причем 10% непрореагировавшего вещества А теряются, а продукт выделяется полностью. Выделенное вещество А можно снова использовать в производстве. Производственные затраты на разделение составляют 1,2 руб (кмоль непрореагировавшего А)-1. Оптовая цена продукта R в пересчете на 1 кмоль 28,4 руб (кмоль R)-1.
Определить максимальный доход при использовании реактора вытеснения и реактора смешения. Найти себестоимость продукта.
Скачать решение задачи 1-1 (ОХТ реактора раз.) (цена 150р)
Задача 1-2 (ОХТ реактора раз.) Реакция между веществами А и В протекает по бимолекулярному закону и через 10 мин завершается на 25%. Через сколько времени завершается реакция на 50%, если исходные вещества в том и в другом случае взяты в стехиометрическом соотношении?
Скачать решение задачи 1-2 (ОХТ реактора раз.) (цена 150р)
Задача 1-3 (ОХТ реактора раз.) При изучении элементарной бимолекулярной реакции в газовой фазе
Cl + H2 → HCl + H
получены опытные значения энергии активации Еа = 23 кДж·моль-1 и предэкспоненциального множителя константы скорости А = 9,5·1013 см3·моль-1·с-1. Используя теорию активированного комплекса, рассчитайте энтальпию и энтропии активации, Sp и Sc, при температуре 300 К.
Скачать решение задачи 1-3 (ОХТ реактора раз.) (цена 150р)
Задача 1-4 (ОХТ реактора раз.) Для реакции R ←(k1)- A -(k2)→ S
с константами k1=2 c-1, k2 =0,7 c-1 требуется определить:
1) Количество молей продуктов R и S, образовавшихся на 1 моль введенного реагента А для реактора идеального вытеснения и реактора идеального смешения, если степень превращения исходного реагента для обоих реакторов равна 0,95;
2) Время пребывания, необходимое для достижения указанной степени превращения в реакторе каждого типа.
Скачать решение задачи 1-4 (ОХТ реактора раз.) (цена 150р)
Задача 1-5 (ОХТ реактора раз.) Для обратимой реакции A ↔ B
а) получите аналитическим путем соотношение между временем релаксации ? и константами скорости k1, k2;
б) определите значения k1, k2, если известны t = 23 мкс и К = 103.
Скачать решение задачи 1-5 (ОХТ реактора раз.) (цена 150р)
Задача 1-6 (ОХТ реактора раз.) В жидкофазном процессе протекает реакция второго порядка 2А → R с константой скорости реакции равной 2,71 л/(моль мин). Объемный расход смеси с концентрацией исходного реагента С равен 4,11 м3/ч.
Определить производительность РИС-н объемом 0,54 м3 по продукту R. Рассчитать объем реактора вытеснения для полученной производительности.
Скачать решение задачи 1-6 (ОХТ реактора раз.) (цена 150р)
Задача 1-7 (ОХТ реактора раз.) В реакторе идеального смешения проходит реакция
A + B -(k1)→ R
R + B -(k2)→ S
S + B -(k3)→ D
константы скорости которой равны (в с (кмоль-3)-1): k1 = 3,8*10-3; k2 = 4,2*10-3; k3 = 6,4*10-3. Плотность реакционной смеси не меняется. Концентрация вещества В соизмерима с концентрацией вещества А. Найти выход по продукту S, если степень превращения вещества А составляет Xa = 0,8 а концентрация продуктов в исходной смеси равна нулю.
Скачать решение задачи 1-7 (ОХТ реактора раз.) (цена 150р)
Задача 1-8 (ОХТ реактора раз.) Реакция 2А → R, где k=6,01*10-3 м3/(моль*с), проходит в РИВ с рециклом. Продукт в исходном растворе отсутствует. Концентрация вещества А в исходном растворе и рецикле равна 2 кмоль/м3 . Производительность реактора по продукту составляет 1,2*10-3 кмоль/с. Объем реактора 1 м3.
Определить объемную скорость рецикла и производительность системы по веществу А.
Скачать решение задачи 1-8 (ОХТ реактора раз.) (цена 150р)
Задача 1-9 (ОХТ реактора раз.) Процесс описывается параллельной реакцией типа
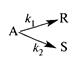
с константами скоростей k1 = 2c-1, k2 = 3 c-1. Объемный поток вещества R CR = 0,5 кмоль/м3, вещества S = 0,6 кмоль/м3. Начальные концентрации веществ CA0 = 4 кмоль/м3, CR0 = CS0 = 0. Определить производительность реактора по продукту R и S
Скачать решение задачи 1-9 (ОХТ реактора раз.) (цена 150р)
Задача 1 В реакторе периодического действия протекает жидкофазная реакция второго порядка A + B -k→ R + S при постоянном объеме и соотношении начальных концентраций исходных веществ CA0 : CB0 = 0,55 : 0,45. Известно, что за t = 80 с степень превращения достигает xB = 30 %. Определить: степень превращения вещества А и В в реакторе идеального смешения и реакторе идеального вытеснения, если соотношение концентраций исходных веществ на входе в реактор остается прежним, а подача исходных веществ А и В осуществляется раздельно (скорости подачи веществ VOA = 1,8*10-3 м3/с, VOB = 2,7*10-3 м3/с. Объем каждого реактора V = 5,2 м3.
Скачать решение задачи 1 (цена 80р)
Задача 2 В РПД протекает жидкофазная реакция второго порядка A + 2B -k→ продукты. Плотность системы не меняется. Константа скорости реакции рассчитывается по веществу А. Соотношение CA0 : CB0 = 1 : 2. Известно, что за время t = 50 с степень превращения по веществу А достигает 12%. Требуется вычислить xА в РИВНД и РИСНД при том же соотношении исходных концентраций, если скорость подачи исходных веществ составляет V0 =2,4*10-2 м3/с, а объем каждого реактора равен V = 5,6 м3. Определить объемы РИВ и РИС, необходимые для достижения рассчитанных выше степеней превращения, если соотношение исходных концентраций веществ будет равно CA0 : CB0 = 1 : 4 (CB0 = const).
Скачать решение задачи 2 (цена 100р)
Задача 3 Параллельная реакция второго порядка:
A + B -k1→ 2R
A + A -k2→ 2S
протекает в РПД при постоянном объеме и соотношении констант скорости k2 = 0,5*k1, (обе задаются по веществу А). Плотность смеси не меняется. При t = 140 с и соотношение исходных концентраций CA0 =3*CB0 xB = 0,62. Определить степень превращения вещества А и В в реакторе идеального вытеснения объемом Vp = 1,4 м3 при скорости подачи смеси V0 = 1,5*10-2 м3/с
Скачать решение задачи 3 (цена 100р)
Задача 4 В реакторе идеального смешения проходит реакция
A + B -k1→ R
R + B -k2→ S
S + B -k3→ D
константы скорости которой равны, м3/(с*кмоль): k1 = 3,8*10-3, k2 = 4,2*10-3, k3 = 6,4*10-3. Давление смеси не меняется. Концентрация вещества В соизмеряется с концентрацией вещества А. Найти выход по продукту S, если xА = 0,80, а концентрация продукта в исходной смеси равна нулю.
Скачать решение задачи 4 (цена 100р)
Задача 5 Рассчитать общее количество теплоты, которое необходимо отводить из реактора полимеризации. Известно, что производительность реактора по сухому веществу 14,3 т/сут. Степень превращения мономера в полимер xM = 0,80; тепловой эффект реакции H = 8,9*105 Дж/кг. Плотность реакционной смеси 1056 кг/м3; cp = 3140 Дж/(кг*К); T0 = 313 К – исходная смесь поступает при температуре; Tp = 307 K – температура реакции. Концентрация мономера в исходной смеси C0 = 40 % (масс). Время реакции 5 ч (18*10^3 с).
Скачать решение задачи 5 (цена 100р)
Задача 6 Рассчитать секционную колонну для варки новолачных смол производительностью по сухой смоле 400 кг/ч. Материальный баланс варки новолачной смолы:
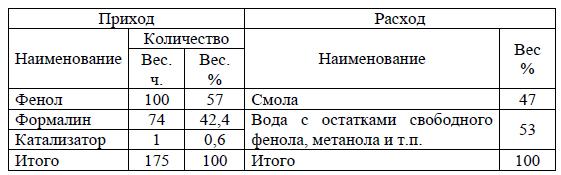
Скачать решение задачи 6 (цена 100р)
Задача 7 В одиночном реакторе непрерывного действия объемом VR = 50 л осуществляется реакция первого порядка со скоростью r = 2,5*10-4 моль*л-1*мин-1. Питание реактора исходной смесью F = 0,5 л*мин-1. Найти состав смеси, выходящей из реактора при различных степенях превращения U (0,3; 0,4 и 0,6), если в реакции участвует 1 моль вещества.
Скачать решение задачи 7 (цена 100р)
Задача 8 Рассчитать константы скоростей двух параллельных реакций первого порядка для гомогенной реакции через 20 лет от начала опыта А -k1→B, А -k1→D CA = 4, CB = 10, CD = 6
Скачать решение задачи 8 (цена 100р)
Задача 9 Сформулировать правило Вангофа. Оцените диапозон значений Е соответствующие этому правилу. Для расчета используйте интервал t. Т1 - Т2 в пределах которого применяется правило Вангофа значение k = 2-4
Скачать решение задачи 9 (цена 100р)
Задача 10 Определите время полуразложения моносилана SiH4 → Si + 2H2 при t = 700 C, если реакция протекает по первому порядку, А = 2*1013, E = 51,1 ккал/моль
Скачать решение задачи 10 (цена 100р)
Задача 11 Скорость реакции увеличивается в три раза при повышении Е = 30-40 при температуре 30 С
Скачать решение задачи 11 (цена 100р)
Задача 12 При Т1 = 300 К реакция первого порядка протекает на 30 К за 200 мин, а Т2 = 325 К за 30 мин. За какой промежуток времени эта реакция пройдет на туже глубину при Т3 = 380 К.
Скачать решение задачи 12 (цена 100р)
Задача 13 Константа скорости реакции CH3Cl2 → CH2=CHCl-CH2Cl. При Т1 = 600 К, k1 = 1,18*10-6 первого порядка, Т2 = 700 Кб k2 = 1,2*10-3. Определить энтальпию, энтропию при 600К
Скачать решение задачи 13 (цена 100р)
Задача 14 Сосуд объемом V = 200 см3 содержится 2H2 и Cl2 подвергается облучениюс л = 420 нм, температура 25С. Облучение света 2*10-6 Дж/с. При облучении реакция смеси 1,5 мин, Р1 = 150, Р2 = 100 поглощается только 70% поданного света
Скачать решение задачи 14 (цена 100р)
Задача 15 Вывести кинетическое уравнение, используя принципы стационарных концентраций
1) CH3CHO -k1-> CH3 + CHO
2) CH3 + CH3CHO -k2-> CH4 + CH3CO
3) CH3CO -k3-> CH3 + CO
4) 2CH3CO -k4-> (CH3CO)2
Скачать решение задачи 15 (цена 100р)
Задача 16 Определить, какое количество вещества можно переработать в реактореидеального смешения периодического действия объемом 5 м3 за сутки, если в нем проводить реакцию типа А → С до степени превращения, равной 0.9. Константа скорости реакции k = 0.04 мин-1. Начальная концентрация реагента СА,0 = 2 моль/л. Время загрузки и выгрузки продукта составляет 30 минут (за одну операцию). Коэффициент заполнения реактора равен 0.8.
Скачать решение задачи 16 (цена 100р)
Задача 17 Реакция А + В ↔ R + S протекает в жидкой фазе и проводится в проточном реакторе идеального смешения объемом 0.12 м3; k1 = 0.118; k2 = 0.05 м3/кмоль•с. В реактор поступают непрерывно с одинаковыми объемными скоростями два потока жидкости, в одном из которых содержится 2.8 кмоль/м3 вещества А, а в другом 1.6 кмоль/м3 вещества В. Требуется определить, с какой скоростью необходимо подавать каждый раствор, чтобы за время пребывания в аппарате прореагировало 75% вещества В. Принять, что плотность жидкости в процессе реакции не изменяется.
Скачать решение задачи 17 (цена 100р)
Задача 18 Реакция типа 2А → R проводится в РИВ, на выходе из которогоконцентрация продукта 0.8 моль/л. Константа скорости реакции 0,24 л/(моль*мин). Начальная концентрация реагента А 1.8 кмоль/м3. Определитеобъем реактора и конечную степень превращения вещества А, еслипроизводительность составляет 3,8 кмоль R в час.
Скачать решение задачи 18 (цена 100р)
Задача 19 (ОХТ-ким). При термическом крекинге пропана в определенных условиях могут быть получены или пропилен и водород, или этилен и метай. Предположим, что пропан подвергается крекингу при пропускании через трубку, которая обогревается снаружи большим количеством горячих газов, имеющих температуру 780 С. Для проектирования промышленной установки требуется определить:
1) размеры реактора, необходимые для достижения 50%-го распада исходного пропана;
2) состав углеводородных газов после реакции. Данные для расчета:
Температура нагревания пропана 720 °С
Диаметр стальной реакционной трубки в, мм:
внутренний 76
внешний 116
Рабочее давление в реакторе, 1 атм
Массовая скорость пропана 330 кг((м2*ч)
Скачать решение задачи 19 (ОХТ-ким) (цена 100р)
Задача 20 (ОХТ-ким.) Определить размеры реактора для окисления хлористого, нитрозила воздухом при температуре 300° С и давлении 5 атм. Конечная степень окисления по условиям равновесия составляет 80%. В реактор поступает 4,88 кмоль/(м2*ч) хлористого нитрозила и 12 кмолъ/(м2 ч) воздуха. Уравнения реакций
2NOCl = 2NO + Cl2
2NO + O2 = 2NO2
Считают, что эти реакции протекают независимо друг от друга.
Константы скоростей реакций при 300 С: разложение NOCl k1 = 10,1*103 мл/(моль*сек)
образование NOCl k1/ = 25,3*109 мл2/(моль2*сек)
образование NO2 k2/ = 1,13*104 л2/((г*эквO2)2*сек)
Константа равновесия реакции окисления NO в NO2 при 300° С: K = k2/k2/ = 447
Скачать решение задачи 20 (ОХТ-ким) (цена 100р)
Задача 21 (ОХТ-ким) Реакция 2A ↔ B + C должна проходить непрерывно в батарее реакторов с перемешиванием. Начальный объемный расход питания равен 10 м3/ч. Концентрация вещества А в исходном питании cA0 =1,5 кмолъ/м3 (концентрации веществ В и С здесь равны нулю}. Константа скорости прямой реакции равна 10 м3/(кмоль ч), а константа равновесия Ке = 16,0. Необходимая степень превращения должна составлять 80% от равновесной.
При использовании только одного реактора определить его объем. Кроме того, найти, сколько аппаратов в батарее потребуется для достижения той же степени превращения, если объем каждого из них равен 0,1 от рассчитанного объема.
Скачать решение задачи 21 (ОХТ-ким) (цена 100р)
Задача 22 (ОХТ-ким) Уксусный ангидрид подвергают гидролизу при 40 С непрерывным способом в реакторе с мешалкой (Vr = 10000 мл). Первичная загрузка водного раствора, содержащего 0,5*10-1 моль/мл уксусного ангидрида, равна 10 л. Массовый расход питания (уксусного ангидрида концентрации 3,0*10-4 моль/мл) постоянен и равен 2 л/мин. С таким же расходом удаляется продукт. Плотность реакционной смеси можно считать постоянной. Скорость реакции (первого порядка) г = kc*c моль/(мл*мин). Константа скорости реакции kc = 0,380 мин-1. Определить время достижения устойчивого режима работы реактора.
Скачать решение задачи 22 (ОХТ-ким) (цена 150р)
Задача 23 (ОХТ-ким) Гексаметилентетрамин (уротропин) получают в реакторе полупериодического действия путем прибавления 7,57 л/мин водного раствора аммиака (концентрация аммиака 25 масс. %) к первоначальной загрузке 900 л формальдегида (концентрация формальдегида 42 масс. %). Температура формальдегида 25° С. Для того чтобы началась реакция, температура формальдегида должна быть 50° С, а раствора аммиака 25° С.
Количество тепла, выделенного в результате реакции, равно 535 ккал/кг уротропина. Если реактор работает при температуре 100° С, скорость реакции становится очень большой по сравнению со скоростью переноса тепла в окружающую среду. Для охлаждения используют змеевик (хладагент - вода). Общий коэффициент теплопередачи Кт = 415 ккал/(м2*ч*град). Расход охлаждающей воды должен быть таким, чтобы температура охлаждающей воды не превышала 25° С.
Дополнительные сведения: плотность раствора аммиака равна 910 кг/м3; плотность формальдегида (42 масс. %) при 25° С равна 1100 кг/м3; теплоемкость смеси реагентов можно считать постоянной С = Са = 0,556 ккал.(кг*град); скорость обратной реакции ничтожно мала. Рассчитать длину змеевика L, если диаметр его трубы Dтр = 25 мм.
Скачать решение задачи 23 (ОХТ-ким) (цена 150р)
Задача 24 (ОХТ-ким) Рассчитать колонну с насадкой для абсорбции аммиака из смеси газов раствором серной кислоты. Парциальное давление аммиака в смеси газов на входе в колонну равно 0,05 ат, на выходе 0,01 ат. Концентрация серной кислоты в абсорбенте на входе 0,6 кмолъ/л3, на выходе 0,5 кмолъ/м3. Частные коэффициенты массопередачи ky = 0.35 кмоль/(м2*ч*ат), kL = 0,005; H = 75 кмоль/(м3*ат); расход смеси газов 45 кмолъ/ч; общее давление 1 ат. Газ и жидкость движутся противотоком.
Реакция протекает с большой скоростью по уравнению и практически необратима (m = b/a = 0,5).
2NH3 + H2SO4 = (NH4)2SO4
Скачать решение задачи 24 (ОХТ-ким) (цена 150р)
Задача 25 (ОХТ-ким) Для абсорбции из смеси газов одного компонента, химически реагирующего с абсорбентом, необходимо иметь поверхность 2060 м2. Известны также следующие данные: 1) вязкость жидкого абсорбента 1 спз; 2) плотность смеси газов p = 0,575 кг/м3, 3) плотность жидкого абсорбента pL = 1000 кг/м3; 4) массовый расход абсорбента L = 14400 кг/ч; 5) объемный расход газа (при рабочей температуре и давлении) Qy = 5400 м3/ч. Определить размеры колонны.
Скачать решение задачи 25 (ОХТ-ким) (цена 150р)
Задача 26 (ОХТ-ким) Нужно определить скорость реакции окисления SO2 в SO3 на платиновом катализаторе в присутствии алюминия в дифференциальном реакторе при общем давлении в системе, равном 790 мм рт. ст.
Необходимо рассмотреть следующие факторы, которые могут оказывать влияние на скорость каталитического процесса: хемосорбцию SO2 и SO3, поверхностную реакцию и десорбцию SO3. Записав уравнения скорости для этих четырех случаев и сопоставив их с экспериментальными наблюдениями, можно определить, нто наиболее медленным этапом процесса является поверхностная реакция.
Для нахождения констант в уравнении скорости необходимо, чтобы в экспериментальных работах изменялось независимо парциальное давление каждого компонента и общее давление, а также чтобы состав смеси оставался постоянным. Поэтому нужно определить изменение степени превращения при постоянном составе и постоянном парциальном давлении индивидуальных компонентов.
Из этого следует, что существует возможность проверки справедливости предложенного уравнения. Однако нельзя найти значения констант равновесия адсорбции.
Экспериментальные данные, полученные при температуре 480° С, приведены в табл. 1
Таблица 1 Экспериментальные данные
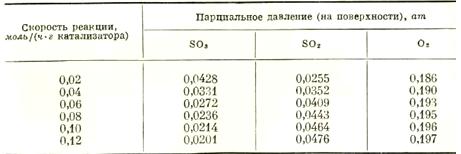
Требуется идентифицировать механизм реакции путем оценки констант уравнения скорости и сопоставления экспериментальных скоростей реакции с вычисленными их значениями.
Скачать решение задачи 26 (ОХТ-ким) (цена 150р)
Задача 27 (ОХТ-ким) Для проведения реакции полимеризации пропена в адиабатическом реакторе требуется определить объемную скорость (количество газа в м3, подаваемого в 1 ч на единицу объема реактора), необходимую для того, чтобы полимеризации подверглось 98% исходного пропена.
Полимеризация проводится при давлении 15 атм. Температура на входе в реактор равна 230° С. Массовая скорость потока 1000 кг/(м2-ч). Исходная смесь состоит из 38 мол.% пропена и 62 мол. % пропана. Частицы катализатора имеют цилиндрическую форму (высота и диаметр равны 6,25 мм). Внешний свободный объем слоя катализатора составляет 50%.
Экспериментальные данные показывают, что в результате реакции получается смесь ненасыщенных углеводородов, имеющая среднюю молекулярную массу 105, среднюю температуру кипения 104,4 °С и плотность 0,71 кг/м? (при 15,6 С).
Для упрощения расчета можно допустить, что реакция полимеризации необратима и активность катализатора настолько высока, что концентрация пропена на активной поверхности катализатора практически равна нулю {реакция определяется диффузией). Падением давления в реакторе мощно пренебречь.
Скачать решение задачи 27 (ОХТ-ким) (цена 150р)
Задача 28 (ОХТ-ким) Рассчитать поверхность охлаждения реактора с движущимся слоем, производящего 100 т винилхлорида в год из газообразного хлористого водорода и ацетилена.
Реактор работает в следующих условиях: Объемный расход, л2/ч:
ацетилена - 5,0
хлористого водорода - 5,5
Тепловой эффект реакции, 36 - 40 ккал/моль
Температура, °С:
реакции 180 - 200
в рубашке - 120
Время контакта, 62 сек
Диаметр частиц катализатора, 60 – 100 мкм
Экспериментальные данные показывают, что скорость движения равна скорости газов в реакторе с неподвижным слоем типа теплообменника для этого же производства. При одинаковых производительностях и скоростях сечение реактора с движущимся слоем будет равно сечению реактора с неподвижным слоем. Реактор с неподвижным слоем имеет 91 трубу (длина каждой трубы L = 3 м). Частицы катализатора имеют размеры 6х2 мм. Общее сечение труб равно 0,114 м2.
Скачать решение задачи 28 (ОХТ-ким) (цена 150р)
Задача 29 (ОХТ-ким) Рассчитать реактор с движущимся слоем для производства 4,5 м3/ч этилена при 20° С путем каталитической дегидрогенизации этана.
Определения, произведенные для реактора с неподвижным слоем типа теплообменника, доказывают, что для полной конверсии температура реакции должна быть равна 375° С, а время контакта 4,8 сек. Тепло, необходимое для проведения реакции (11 ккал/молъ), получают с помощью системы электрического нагревания. Для испарения спирта используют теплообменник (теплоноситель - пар)
Скачать решение задачи 29 (ОХТ-ким) (цена 150р)
