Задачи на получение каустической и кальцинированной соды
Задача 8.1 Концентрация СаО в известковом молоке равна 189 н. д. Определить содержание СаО и Са(ОН)2 в молоке, а также концентрацию ионов Са2+ и OH- (в г/дм3).
Скачать решение задачи 8.1 (цена 50р)
Задача 8.2. Определить расход соды и гидроокиси кальция для очистки 1 м3 рассола, содержащего 6,71 кг - CaSO4, 0,63 кг - МgCl2 и 0,33 кг - CaCl2.
Скачать решение задачи 8.2 (цена 50р)
Задача 8.3 Вычислить расход извести и соды, если рассол содержит 1,7 н. д. Са2+ и 0,5 н. д. Мg2+. Содержание NaOH в очищенном рассоле 0,08 н. д., избыток соды 0,3 н. д,
Скачать решение задачи 8.3 (цена 70р)
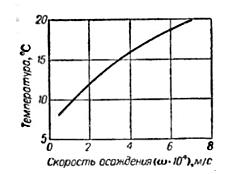
Задача 8.4 Определить производительность отстойника для очистки рассола диаметром 18 м. Отстаивание происходит при - 15-17 °С. Скорость осаждения шлама в зависимости от температуры представлена на рис.
Скачать решение задачи 8.4 (цена 60р)
Задача 8.5 До какой температуры может нагреться рассол при насыщении его аммиаком до концентрации 80,7 г/дм3, если не отводить теплоту?
Вместе с аммиаком со станции дистилляции поступает водяной пар в количестве 400 кг на 1000 кг аммиака Одновременно с аммиаком 1 м3 рассола поглощает 49,1 кг СО3.
Теплоемкость рассола С = 3,27 кДж/(кг-К).
Плотность аммонизированного рассола 1175 кг/м3.
Теплоты растворения: NH3 - 35 400 кДж/кмоль, CO2 - 24 700 кДж/кмоль.
Теплота нейтрализации СО2 до (NH3)2CO3 - 70 500 кДж/кмоль
Условно принято, что водяной пар конденсируется в абсорбере при 55 °С; теплота конденсации водяного пара при 55 °С - 2360 кДж/кг.
Начальная температура рассола 25 °С.
Расчет ведем на 1000 кг абсорбируемого аммиака.
Скачать решение задачи 8.5 (цена 70р)
Задача 8.6 Составить материальный баланс первого абсорбера (АБ-1). Состав поступающей жидкости (в н. д.): Cl- - 102,5; NH3 - 19,2; СО2 - 7,9; плотность рассола 1197 кг/м3.
Количество жидкости, орошающее АБ-1: 5,19м3 на 1000кг соды. В этом количестве жидкости содержится 36,2 кг Na2SO4 и 4,7 кг примесей. Состав выходящей жидкости (в н. д.): Cl- - 95,4; NH3 - 61,2; СО2 - 27,1; плотность рассола 1179 кг/м3. Количество и состав газовой смеси, поступающей из АБ-2 в АБ-1, (в кг на 1000 кг соды): 293,9 - NH3, 122,3 - СО2, 41,98 - Н2О, 10 - воздуха. Расчет ведем на 1000 кг соды.
Скачать решение задачи 8.6 (цена 100р)
Задача 8.7 Составить материальный баланс второго абсорбера (АБ-2)
Состав жидкости, вытекающей из АБ-2 (в н. д.): NH3 - 98,3; С1- - 88; СО2 - 39,8; плотность жидкости 1168 кг/м3. Состав газа, поступающего в АБ-2 (в кг на 1 т соды): NH3 - 422,1; СО2 - 220,8; Н2О - 212,98; воздуха - 10. Расчет ведем на 1000 кг соды. Состав жидкости, поступающей в АБ-2, был рассчитан в предыдущей задаче.
Скачать решение задачи 8.7 (цена 100р)
Задача 8.8 Рассчитать температуру аммонизированного рассола, вытекающего из второго абсорбера (АБ-2), в условиях предыдущего Скачать решение задачи Задачаа, если жидкость, поступающая в АБ-2 из АБ-1, предварительно охлаждается в оросительном холодильнике до 30 °С. Температура газа, поступающего в АБ-2, 50 °С; температура стенки аппарата 55 °С; температура наружного воздуха 15 °С; теплоемкость жидкости, вытекающей из АБ-2, 3,27 кДж/(кг-К).
Диаметр АБ-2 равен 2,8 м, высота 7,4 м. Производительность абсорбера по соде 17,6 т в 1 ч. Расчет ведем на 1000 кг соды.
Скачать решение задачи 8.8 (цена 70р)
Задача 8.9 Аммонизированный рассол карбонизируют до получения раствора, насыщенного NaHCO3, NH4Cl и NH4НСО3. Конечная температура карбонизации 32 °С. Определить:
количество NaCl, необходимое для получения 1000 кг NaHCO3; степень использования натрия и аммиака; концентрацию исходного раствора NaCl,
Скачать решение задачи 8.9 (цена 50р)
Задача 8.10 Определить степень использования натрия при карбонизации, если концентрация хлорида аммония в маточной жидкости 187 г/дм3, а концентрация иона хлора 177,5 г/дм3.
Скачать решение задачи 8.10 (цена 60р)
Задача 8.11 Определить количество рассола (в м3), необходимое для получения 1000кг стандартной 99,2 %-ной соды, если концентрация хлорида натрия в рассоле 106 н. д., а степень использования натрия 67%.
Скачать решение задачи 8.11 (цена 70р)
Задача 8.12 Определить расход рассола, известняка (100% СаСО3) и аммиака (100% NH3) для получения 1000 кг соды (99,2% Na2CO3), если содержание NaCl в рассоле 306,1 г/дм3, а степень превращения NaCl в соду составляет 74%,
Скачать решение задачи 8.12 (цена 70р)
Задача 8.13 Рассчитать коэффициенты использования натрия и аммиака, количество поглощенного СО2 и количество выдуваемого аммиака в карбонизационной колонне.
Исходные данные
Количество веществ, поступающих в колонну с жидкостью кг/1000 кг №аСО8;
NaCl - 1550,1; (NH3)2CO3 - 923; NH3OH - 337,4; H2O - 4230,2; примесь - 21,6
Состав жидкости, выходящей из колонны, н. д.:
Cl- - 96; прямой титр - 24; общий титр - 95; связанный NH3 - 71; CO2 - 37
Количество жидкости на 1000 кг соды 5,54 м3, ее плотность 1108 кг/м3.
Скачать решение задачи 8.13 (цена 70р)
Задача 8.14 Рассчитать производительность барабанного вакуум-фильтра БС 5,6- 1,8/1,0 для фильтрации бикарбоната. Диаметр барабана фильтра D = 1,8 м, длина барабана 1 м. Ширина слоя бикарбоната на фильтре L = 0,98 м. Скорость вращения барабана фильтра 1 мин-1. Толщина слоя осадка на фильтре б = 40 мм. После срезания ножом на фильтре остается слой осадка толщиной б' = 5 мм. Коэффициент выхода соды из бикарбоната 0,52; плотность осадка 1320 кг/м3.
Скачать решение задачи 8.14 (цена 70р)
Задача 8.15 Составить тепловой баланс и определить расход природного газа для кальцинации 1000 кг бикарбоната натрия в печах кальцинации с наружным обогревом.
Исходные данные
Выход соды из бикарбоната натрия 63%.
Влажность бикарбоната натрия 14%.
Содержание NH4HCO3 в бикарбонате натрия 3,5%.
Температуры, в °С, начальные: бикарбоната натрия^природ-ного газа и воздуха 25; выходящей из сушилок соды 140; выходящего из сушилок газа 140; топочных газов на выходе 380.
Теплота горения природного газа 33 430 кДж/кг.
Удельные теплоемкости, в кДж/(кг-К): природного газа - 0,84; сырого бикарбоната - 1,84; соды - 1,09; воздуха - 1,26 и топочного газа - 0,84. Теплопотери в окружающую среду составляют 25% от общего количества расходуемой теплоты. На сгорание 1 кг природного газа расходуется 17,5 кг воздуха.
Скачать решение задачи 8.15 (цена 70р)
Задача 8.16 Рассчитать необходимое количество рассола для содового завода производительностью 210 000 т/год (600 т/сут) 99,2%-ной кальцинированной соды, если рассол, плотность которого 1,21 т/м3, содержит 312 г/дм3 NaCl, а часть соды идет на приготовление 50 000 т/год едкого натра при расходе 1,335 т Na2CO3 на 1 т каустической соды.
Скачать решение задачи 8.16 (цена 70р)
Задача 8.17 Определить расход пара на дистилляцию аммиака из жидкости в расчете на 1000 кг соды при следующих условиях работы дистиллера:
объем жидкости, поступающей из ТДС - 7м3; объем известкового молока - 2,5 м3; содержание в поступающей жидкости NH3 в виде NH4HCO3 - 150 кг; NH3 в виде NH4OH - 350 кг; CO2 - 39 г/дм3; давление используемого пара 172,2 кПа (115 C)
теплота конденсации пара при 115 С - 2220 кДж/кг; теплопотери за счет излучения - 10% от общего расхода теплоты; температура жидкости, поступающей в ТДС - 45 С; температура известкового молока, поступающего в смеситель - 55 Сю
Удельную теплоемкость жидкостей принять равной 3,41 кДж/(кг-К).
Скачать решение задачи 8.17 (цена 70р)
Задача 8.18 Составить материальный баланс дистиллера, если жидкость, поступающая в него из смесителя, содержит, %:
NaCl - 4,51; NH3 - 4,08; CaCl2 - 10,9; CaSO4 - 0,09; Ca(OH)2 - 0,05; H2O - 80,34
Плотность раствора 1104 кг/м3; количество раствора, поступающего в дистиллер на 1000 кг соды, 8,84 м3. Вместе с жидкостью из смесителя поступают взвешенные частицы (в % от массы жидкости): Са(ОН)2 - 1,180 и СаСО3 - 1,525; в нижнюю часть дистиллера подают водяной пар в количестве 159,5 кг на 1 т раствора. Жидкость, выходящая из дистиллера, уносит NH3 в количестве 1 кг на 1000 кг соды. Содержание аммиака в газе, выходящем из дистиллера, 29,4% (масс). Расчет ведем на 1000 кг соды.
Скачать решение задачи 8.18 (цена 100р)
Задача 8.19 Исходя из условий предыдущей задачи, составить тепловой баланс дистиллера на 1000 кг соды. Температура жидкости, поступающей из смесителя, 89 °С; теплоемкость 3,41 кДж/(кг К) Теплоемкость осадка 1,05 кДж/(кг К). Температура газа, выходящего из дистиллера, 97 °С. Теплоемкость аммиака 2,18 кДж/(кг К). Теплопотери 0,4%
Скачать решение задачи 8.19 (цена 70р)
Задача 8.20 Рассчитать материальный и тепловой балансы пенного дистиллера слабой жидкости завода кальцинированной соды.
Количество слабой жидкости 44 м3/ч. Состав жидкости (в н. д.): общий титр NH3 - 41; Na2CO3 - 5; СО2общ - 47. Плотность жидкости 1050 кг/м3, флегмы 1040 кг/м3.
Температуры, °С: жидкости 61; флегмы 88 (на ДСЖ); сбросовой жидкости 104; газа, выходящего из ДСЖ в ХГДСЖ, 90, а газа, выходящего из ХГДСЖ, 60.
Теплоемкости, кДж/(кг-К): слабой жидкости и флегмы 3,82; отходящей (сбросовой) жидкости 3,9. Параметры пара: Р = 122 кПа, t = 105 °С; расход пара 275 кг/м3 жидкости.
Давление вверху ДСЖ - 97,2 кПа, вверху ХГДСЖ - 95,2 кПа. Схема потоков показана на рис. VIII.5 (стр. 437). Дистиллер слабой жидкости связан непосредственно с холодильником отходящих от него газов. Водяные пары, содержащиеся в отходящих от ДСЖ газах, конденсируются с образованием слабого раствора аммиачных соединений. Последний стекает обратно в ДСЖ в виде флегмы.
Скачать решение задачи 8.20 (цена 100р)
Задача 8.21 Определить степень обжига известняка, если обожженная известь содержит: 87% СаО, 8% СаСО3 и 5% примесей. Расчет ведем на 100 кг извести, содержащей 87 кг СаО
Скачать решение задачи 8.21 (цена 50р)
Задача 8.22 Вычислить концентрацию СО2 в печном газе, образующемся при обжиге известняка. Расход углерода соответствует теоретическому, а диссоциация карбоната кальция происходит согласно реакции:
СаСО3 = СаО + СО2 - 178 кДж
При диссоциации СаСО3 образуется газ, на 100% состоящий из СО2, а при сгорании углерода в теоретическом количестве воздуха образуется газ, содержащий 21% (об.) СО2.
Скачать решение задачи 8.22 (цена 70р)
Задача 8.23 Вычислить теоретическое содержание СО2 в печном газе при расходе в качестве топлива 6,5 кг углерода на обжиг 100 кг CaCO3 и при использовании обогащенного кислородом воздуха, содержащего 28% (об.) О2.
Скачать решение задачи 8.23 (цена 70р)
Задача 8.24. В цех известковых печей поступает известняк следующего состава: 89,9% СаСО3; 5,94% MgCO3; 4,16% кремнеземистых веществ и кокс, содержащий 85,25% С и 14,75% золы.
Расход топлива равен 7,5 кг на 100 кг извести. Температура в зоне реакции 1050 °С. Температура поступающего воздуха и извести 15 °С, выгружаемой извести 50 °С.
Допуская, что: углерод топлива сгорает полностью; в отходящих газах отсутствует окись углерода и карбонаты разлагаются нацело, рассчитать: выход извести; расход воздуха, потребного для горения; до какой температуры может быть подогрет воздух за счет теплоты извести; количество образующихся газов; температуру выходящих из печи газов после охлаждения их известняком и топливом.
Расчет ведем на 100 кг известняка.
Скачать решение задачи 8.24 (цена 70р)
Задача 8.25 Определить состав и количество газов, выделяющихся из шахтной известково-обжигательной печи.
Рабочий состав топлива, %
Cp - 80,1; Hp - 1,6; Sp - 1,7; Np - 1,0; Op - 0,9; Ap - 9,2; Wp - 5,5
Состав известняка, %:
CaCO3 - 93,5; MgCO3 - 0,5; Me2O3 + SiO2 - 3; H2O - 3
Температура наружного воздуха, известняка и топлива 15 °С.
Скачать решение задачи 8.25 (цена 70р)
Задача 8.26 Рассчитать степень каустификации кальцинированной соды, если в феррите содержится: 20,8% NaOH и 3,1% Na2CO3.
Скачать решение задачи 8.26 (цена 50р)
Задача 8.27 Определить количество содовой пыли (в %), уносимой отходящими топочными газами из ферритной печи, если в печь загружают смесь, содержащую 26,9% Na2CO3 и 13,3% Н2О, а из печи выходит феррит, в котором содержится 20,8% и 2,9% Na2CO3.
Скачать решение задачи 8.27 (цена 70р)
Задача 8.28 Определить массу осадка солей, образующихся при выпарке щелочи и возвращаемых в ферритную печь, если состав суспензии до фильтрации (в г/дм3): Na2CO3 - 94,7%; NaOH - 644,7%; состав маточного раствора после фильтрации (в г/дм3) Na2CO3 - 18,6, NaOH - 666. Осадок содержит 50,2% - Na2CO3 и 4,4% - NaOH.
Скачать решение задачи 8.28 (цена 60р)
Задача 8.29. В смеситель загружают на 1000 кг продукта: 95%-ную кальцинированную соду (А); промытую окись железа (Е), содержащую, в % - Fе2О3 - 71,3 (u); NaOH - 0,77 (k); Na2CO3 - 0,89 (р); содовую пыль (у); осадок солей выпарки (В), содержащий, в % -
Na2CO3 - 50,2 (a): NaOH - 4,4 (s) В ферритную печь загружают смесь С следующего состава, ъ %: Na2CO3 - 26,9 (c); Fe2O3 - 56,6 (b); H2O - 13,3 (w)
Из ферритной печи выгружают плав Ф, содержащий, в %: NaOH - 20,8 (c); Na2CO3 - 2,9 (d); Fe2O3 - 73,2 (m)
Принимая, что: A = 1350 кг; B = 218,1 кг; y = 16,2%, определить количество образовавшегося феррита и количество материалов, поступивших в смеситель.
Скачать решение задачи 8.29 (цена 60р)
Задача 8.30 Составить материальный баланс ферритной печи, если в печь поступает 7413 кг/ч шихты, содержащей 26,9% Na2СО3; 55,6% Fе2О3; 13,3% Н2О и 4,2% примесей. Выгружаемый феррит содержит 18,8% NaOH; 3,1% Na2СО3; 73,2% - Fe2O3. Пыль, уносимая топочными газами, содержит 88,6% Na2CO3 и 11,4% Fe2O3. Общий унос соды с пылью составляет 24,4%.
Скачать решение задачи 8.30 (цена 100р)
Задача 8.31 Подсчитать расход мазута, подаваемого в форсунку ферритной печи, если, по данным теплового баланса, необходимо обеспечить приход теплоты в печь 20 950 000 кДж/ч. Температура мазута 90 °С. Для распыления мазута используются пар с давлением 1013 кПа и t = 300 °С. Количество пара составляет 60% от массы мазута. Сжигают мазут с помощью воздуха. Расход воздуха 11 м3/кг; температура воздуха 20 °С.
Скачать решение задачи 8.31 (цена 70р)
Задача 8.32 Подсчитать состав гашеного феррита (в рас чете на сухое вещество) и расход воды при условии, что в реакцию вступит 50% Na2O*Fе2О3 и гашение производят водой.
На гашение поступает спек, содержащий, кг: Na2CO3 - 167,3, Fe2O3 - 2040,2; Na2O*Fe2O3 - 2803 и примеси - 311,3.
Скачать решение задачи 8.32 (цена 70р)
Задача 8.33 Определить количество и состав промытой окиси железа, возвращаемой в ферритную печь, если из нее выходит спек, содержащий, в кг: Na2O*Fе2О3 - 2803, Fe2О3 - 2040. После операций гашения и выщелачивания весь феррит разлагается с образованием NaOH и активной окиси железа, Промытая окись железа содержит 71,3% - Fe2О3; 0,77% - NaOH; 0,89% - Na2CO3 и 5,46% примесей.
Скачать решение задачи 8.33 (цена 70р)
Задача 8.34 Рассчитать количество воды, удаляемой из раствора NaOH при двухступенчатой его упарке, и расход пара по корпусам. Производительность установки 2 т/ч NaOH. Концентрация растворов: перед выпаркой 28,4%; после выпарки в первом корпусе 33,1%; после выпарки во втором корпусе 43,5%. Давление греющего пара 911,7 кПа. Давление сокового пара в выпарных аппаратах (в кПа): в первом корпусе - 173,3, во втором корпусе - 13,3. Температура исходного раствора 100 °С. Температура сокового пара снижается на 1,5 °С при передаче его для обогрева выпарного аппарата следующей ступени выпарки. Теплопотерями можно пренебречь
Скачать решение задачи 8.34 (цена 70р)
Задача 8.35 Определить количество теплоты, затрачиваемой в первом котле подогревательной батареи на испарение воды в расчете на 1000 кг 92%-ной каустической соды, если в котел поступает щелок, содержащий 52%-ную NaOH, а выходит 55,1%-ный щелок.
Скачать решение задачи 8.35 (цена 70р)
Задача 8.36 Составить материальный баланс гасителя-каустификатора, если в него подается содовый раствор, содержащий 60 н. д. Na2CO3 и 20 н. д. NaOH, и известь, содержащая 85% активной окиси кальция. (Для упрощения расчета принять, что в состав 1000 кг извести входит только 850 кг СаО и 150 кг СаСО3). На 1000 кг 92%-ной каустической соды расходуется 1000 кг извести. Избыток против теоретического количества 5%. Плотность содового раствора 1150 кг/м3. Степень каустификации раствора в гасителе-каустификаторе 75%. С отбросами теряется 60 кг 85%-ной извести, 101 кг CaCO3 и 6 кг Na2CO3. Влажность отбросов 20%. При промывке отбросов получается 312,1 кг раствора с общей щелочностью (в пересчете на Na2CO3) 4,8%.
Скачать решение задачи 8.36 (цена 100р)
Задача 8.37 Исходя из условий предыдущей задачи, составить материальный баланс каустификатора, если из гаси-теля-каустификатора в него поступает суспензия со степенью каустификации раствора, равной 75%. Степень каустификации раствора после каустификатора составляет 85%,
Скачать решение задачи 8.37 (цена 70р)
Задача 8.38 Как зависит суточная производительность отстойника шлама первой каустификации от температуры обжига известняка? Диаметр отстойника 9 м. Содержание NaОН в щелоке 14%; плотность щелока 1160 кг/м3. Скорость осаждения шлама в зависимости от температуры обжига извести:
t, °С 900 1000 1200
w*10^5, м/с 3,1 3,7 4,3
Скачать решение задачи 8.38 (цена 70р)
