Решение задач 1-30 (методичка 120)
Задача №1.
Перечислите положения квантовой (волновой) механики, на которых основана теория строения электронной оболочки атома.
Что Вы понимаете под квантовым характером излучения и поглощения энергии веществом в микромире?
Приведите электронную конфигурацию атома элемента с порядковым номером 25. Назовите число орбиталей атома этого элемента, имеющих в основном состоянии атома по одному электрону.
Охарактеризуйте набором квантовых чисел каждую из 3d – орбиталей.
Какое максимальное число электронов атома может находится в энергетическом 3d – состоянии.
Скачать решение задачи 1 (методичка 120в) 90р
Задача №2.
Перечислите положения квантовой (волновой) механики, на которых основана теория строения атома.
Что понимают под волновым характером движения микрочастиц?
Приведите электронную конфигурацию а) атома железа и б) иона железа (III).
Укажите число орбиталей атома железа, имеющих в основном состоянии атома по одному электрону.
Опишите форму орбиталей, характеризующихся следующим набором квантовых чисел: n=3; 1=2; m1 = 0, ±1 = ±2
Скачать решение задачи 2 (методичка 120в) 90р
Задача №3.
Перечислите представления квантовой (волновой) механики, на которых основана теория строения атома.
Приведите электронную конфигурацию:
а) атома сурьмы;
б) иона сурьмы (III).
Составьте энергетическую схему распределения по орбиталям электронов атома сурьмы.
Охарактеризуйте набором квантовых чисел 5s – орбиталь. Какое максимальное число электронов может находиться в энергетическом 5p – состоянии?
Скачать решение задачи 3 (методичка 120в) 90р
Задача №4.
Как можно описать состояние электрона в атоме?
Изобразите графически расположение одной s- и трех p- орбиталей относительно осей координат.
Опишите форму орбитали, характеризующейся квантовыми числами: n=6; 1=0; m1=0
Приведите электронную конфигурацию атома бария.
Какое максимальное число электронов может находиться в энергетическом 6p – состоянии?
Скачать решение задачи 4 (методичка 120в) 90р
Задача №5.
На основе представлений квантовой механики сформулируйте понятие «электронное облако».
Какую форму имеют: а) s-орбиталь; б) p-орбиталь? Изобразите их графически.
Приведите электронную конфигурацию атома мышьяка.
Охарактеризуйте набором квантовых чисел каждую из 4p-орбиталей.
Скачать решение задачи 5 (методичка 120в) 90р
Задача №6.
Определите понятие «орбиталь» на основе представлений квантовой (волновой) механики.
Опишите форму орбиталей, характеризующихся квантовыми числами:
n= 4, l=2, m1 =0, ±1, ±2
Приведите электронную конфигурацию атома технеция. Составьте энергетическую схему распределения электронов по орбиталям в атоме технеция.
Укажите суммарное спиновое число 4d-электронов атома технеция.
Скачать решение задачи 6 (методичка 120в) 90р
Задача №7.
Дайте определение понятию «орбиталь» на основе представлений квантовой (волновой) механики.
Постройте модели d- орбиталей.
Приведите конфигурацию атома титана.
Определите число 3d – орбиталей атома титана, не заполненных электронами в основном состоянии отома.
Охарактеризуйте набором квантовых чисел 4s – орбиталь.
Какое максимальное число электронов может находиться в энергетическом 4p – состоянии?
Скачать решение задачи 7 (методичка 120в) 90р
Задача №8.
Известно, что орбиталь можно охарактеризовать набором квантовых чисел. Приведите названия квантовых чисел и объясните их физический смысл.
Опишите набором квантовых чисел 3s-орбиталь
Приведите электронную конфигурацию атома рутения.
Составьте энергетическую схему распределения электронов по орбиталям предвнешнего уровня атома рутения. Какое максимальное число электронов может находиться в энергетическом 4d-состоянии?
Скачать решение задачи 8 (методичка 120в) 90р
Задача №9.
Как записывается главное квантовое число?
Для чего оно используется?
Какая из схем отражает распределение электронов по s и p-орбиталям валентной оболочки атома индия:
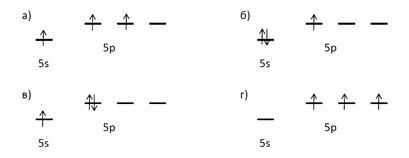
Дайте пояснения к ответу
Составьте электронную конфигурацию иона индия (I)
Охарактеризуйте набором квантовых чисел каждую из 5p-орбиталей. Какое максимальное число электронов может находиться в энергетическом 5d-состоянии?
Скачать решение задачи 9 (методичка 120в) 90р
Задача №10.
Определите понятия: а) энергетический уровень, б) энергетический подуровень. Приведите электронную конфигурацию атома гафния; составьте энергетическую схему распределения электронов по орбиталям предвнешнего уровня атома гафния.
Охарактеризуйте набором квантовых чисел каждую из 5d-орбиталей. В какой последовательности заполняются электронами 4f, 5d, 6s-орбитали?
Скачать решение задачи 10 (методичка 120в) 90р
Задача №11.
1. Приведите обозначение орбитального квантового числа, охарактеризуйте его применение/
2. Какие значения принимает орбитальное квантовое число для данного главного квантового числа: а) n=1, б) n=2.
3. Атом какого элемента имеет электронную конфигурацию:
1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p4
Дайте пояснения
4. Назовите число орбиталей данного атома, имеющих в основном состоянии атома по одному электрону.
Скачать решение задачи 11 (методичка 120в) 90р
Задача №12.
Строение вещества. Электронная оболочка.
Какие значения принимает орбитальное квантовое число для данного квантового числа:
а) n = 3;
б) n = 4?
Какая из электронных конфигураций соответствует иону кобальта (I I).
а) 1s22s22p63s23p63d54s2
б) 1s22s22p63s23p63d74s2
в) 1s22s22p63s23p63d54s0
Составьте энергетическую схему распределения электронов по орбиталям атома кобальта. Охарактеризуйте набором квантовых чисел каждую из 3p-орбиталей.
Какое максимальное число электронов может находиться в энергетическом 4p-состоянии?
Скачать решение задачи 12 (методичка 120в) 90р
Задача №13.
Приведите обозначение магнитного квантового числа и объясните его физический смысл.
Чему равно число орбиталей, характеризующихся следующими значениями орбитального квантового числа: а) l = 0, б) l = 1
Приведите электронную конфигурацию йода.
Составьте энергетическую схему распределения электронов по орбиталям атома йода.
Какое максимальное число электронов может находится в энергетическом 4f-состоянии?
Скачать решение задачи 13 (методичка 120в) 90р
Задача №14.
Сформулируйте правило, которым определяется число орбиталей данного энергетического уровня.
Опишите форму орбиталей, характеризующихся квантовыми числами: n = 3, l = 1, ml = 0, ± 1. Как направление p-орбитали вдоль осей координат?
Приведите электронную конфигурацию атома теллура.
Какая из схем отражает распределение электронов по s- и p-орбиталям внешнего уровня в атоме теллура:

Дайте пояснение к ответу.
Какое максимальное число электронов может находиться в энергетическом 5-f состоянии?
Скачать решение задачи 14 (методичка 120в) 90р
Задача №15.
Укажите число орбиталей, характеризующихся значениями орбитального квантового числа: а) l = 2, б) l = 3
Приведите электронную конфигурацию атома сурьмы.
Составьте энергетическую схему распределения электронов по орбиталям атома сурьмы.
Охарактеризуйте набором квантовых чисел каждую из 4f-орбиталей.
Какое максимальное число электронов может находиться в энергетическом 4f-состоянии?
Скачать решение задачи 15 (методичка 120в) 90р
Задача №16.
Приведите обозначение спинового квантового числа, объясните его физический смысл.
Приведите электронную конфигурацию атома серы.
Составьте энергетическую схему распределения электронов по орбиталям атома серы.
Охарактеризуйте набором квантовых чисел каждую из 2p-орбиталей.
Скачать решение задачи 16 (методичка 120в) 90р
Задача №17.
Перечислите правила, используемые при составлении электронной конфигурации атома.
Приведите электронную конфигурацию атома олова.
Объясните, как согласно принципу наименьшей энергии, происходит заполнение электронами орбиталей внешнего слоя атома олова.
Рассчитайте значение суммарного спинового числа p-электронов внешнего слоя атома олова.
Охарактеризуйте набором квантовых чисел 7s-орбиталь.
Скачать решение задачи 17 (методичка 120в) 90р
Задача №18.
Приведите правила составление электронной конфигурации атома.
Какова электронная конфигурация атома селена?
Составьте энергетическую схему распределения электронов по орбиталям атома селена.
Объясните, как используют принцип Паули при заполнении электронами внешнего слоя атома селена.
Какой набор квантовых чисел соответствует 2s-орбитали?
Скачать решение задачи 18 (методичка 120в) 90р
Задача №19.
Согласно каким правилам, происходит заполнение электронной оболочки атома?
Назовите элемент с электронной конфигурацией атома:
1s22s22p63s23p63d34s2
Объясните действие правила Гунда при заполнении электронами 3d и 4s-орбиталей данного элемента?
Опишите форму орбиталей, характеризующейся квантовыми числами: n = 4, l = 0, ml = 0.
Какое максимальное число электронов может находится в энергетическом 4p-состоянии?
Скачать решение задачи 19 (методичка 120в) 90р
Задача №20.
Опишите форму орбиталей, характеризующихся следующим набором квантовых чисел: n=4; l=1, ±1.
Правильно ли составлена электронная конфигурация атома висмута:
1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p3? При ответе проанализируйте положение висмута в периодической таблице. Составьте энергетическую схему распределения по орбиталям электронов атома висмута.
Чему равно суммарное спиновое число р-электронов внешнего слоя атома висмута?
Какое максимальное число электронов может находиться в энергети-ческом 6d-состоянии?
Скачать решение задачи 20 (методичка 120в) 90р
Задача №21.
Современная формулировка периодического закона Д.И.Менделеева выглядит следующим образом: свойства химических элементов находятся в периодической зависимости от заряда их атомных ядер.
Прокомментируйте выражение: «По мере роста атомного номера элемента периодически повторяются сходные электронные конфигурации валентных электронов, чем и объясняется периодический характер изменения свойств в ряду химических элементов».
Скачать решение задачи 21 (методичка 120в) 90р
Задача №22.
Прокомментируйте выражение: «В периоде закономерно изменяется электронная конфигурация атома, а также значение высшей степени окисления элементов». Поясните сказанное на примере элементов
3 – го периода. Составьте формулы оксидов, отвечающих высшей степени окисления элементов 3 – го периода.
Скачать решение задачи 22 (методичка 120в) 90р
Задача №23.
Охарактеризуйте кислотно-основные свойства оксидов элементов 3-го периода в их высшей степени окисления. В обосновании ответа приведите уравнение реакций взаимодействия оксидов данных элементов с водой (учтите, что некоторые оксиды в воде не растворяются)
Скачать решение задачи 23 (методичка 120в) 90р
Задача №24.
Как вы понимаете выражение: «В периоде при переходе от одного элемента к другому наблюдается ослабление основных и усиление кислотных свойств их оксидов». При ответе используйте уравнения реакции взаимодействия оксидов элементов 2-го периода в их высшей степени окисления с водой (учтите, что оксид бериллия в воде не растворяется).
Скачать решение задачи 24 (методичка 120в) 90р
Задача №25.
Прокомментируйте выражение: «Для элементов периода переход от основных к кислотным оксидам и гидроксидам осуществляется через амфотерный оксид и гидроксид».
Подтвердите уравнениями реакций амфотерность оксида и гидроксида алюминия.
Скачать решение задачи 25 (методичка 120в) 90р
Задача №26.
Определите понятия: а) группа химических элементов; б) подгруппа химических элементов. Опишите структуру VII-ой группы периодической таблицы.
Приведите формулы оксидов и гидроксидов хлора и марганца, отвечающих их высшей степени окисления.
Скачать решение задачи 26 (методичка 120в) 90р
Задача №27.
Назовите признак, по которому: а) элементы образуют данную подгруппу; б) элементы формируют данную группу. Ответ дайте на примере IV-ой группы периодической таблицы.
Скачать решение задачи 27 (методичка 120в) 90р
Задача №28.
Укажите элементы VI-ой группы, входящие в: а) в главную подгруппу, б) побочную подгруппу. К s-, p- или d- элементам они относятся? В чем сходство и различие в структуре атомов элементов этих подгрупп? Приведите формулы оксидов 6-ой группы, отвечающих их высшей степени окисления.
Скачать решение задачи 28 (методичка 120в) 90р
Задача №29.
Определите понятие «атомный радиус». Как вы понимаете выражение: «В периодах по мере увеличения заряда радиусы атомов в общем уменьшаются».
Скачать решение задачи 29 (методичка 120в) 90р
Задача №30.
Дайте определение понятию «атомный радиус». Как вы объясните то, что в подгруппах элементов радиусы атомов, в общем увеличиваются?
Скачать решение задачи 30 (методичка 120в) 90р
