Решение задач 61-90 (методичка 120)
Задача №61.
Дайте ответ на вопросы: а) почему химические реакции сопровождаются энергетическими изменениями; б) почему в ходе реакции изменяется энтропия системы?
Сформулируйте ответ, используя уравнения реакции:
2H2(г) + O2(г) = 2H2О(г), ΔН0298 = -484 кДж; ΔS0298 = -87 кДж
Воспользуйтесь приведенными данными для расчета изменения энергии Гиббса и заключения о возможности протекания реакции горения водорода в стандартных условиях.
Скачать решение задачи 61 (методичка 120в) 90р
Задача № 62.
При изобарном процессе тепловой эффект реакции определяется как изменение энтальпии реакции системы
CaO(к) + CO2(г) = CaCO3(к)
ΔН0f,298, кДж/моль -635 -393 -1207
ΔS0f,298, кДж/моль 40 214 93
в стандартных условиях
Как изменяется энтропия в приведенной реакции?
Подтвердите свой вывод расчетами.
Оцените возможность самопроизвольного протекания данной реакции в стандартных условиях на основе значений ΔН0f,298, ΔS0f,298 , ΔG0f,298
Скачать решение задачи 62 (методичка 120в) 90р
Задача № 63
Чем отличается термохимическое уравнение реакции от обычного уравнения реакции?
Составьте термохимическое уравнение реакции
2KClO3(к) = 2KCl(к) + 3O2(г)
ΔН0f,298, кДж/моль -391 -436 0
ΔS0f,298, кДж/моль 143 83 205
Каков знак изменения энтропии в приведенной реакции? Подтвердите ответ соответствующими расчетами. Объясните, почему этот процесс необратим.
Скачать решение задачи 63 (методичка 120в) 90р
Задача №64.
При протекании экзотермической реакции энтальпия системы уменьшается . К таким процессам: экзо- или эндотермическим относятся реакции:
а) H2(г) + 3H2(г) = 2 NH3(г)
ΔН01,298 кДж/моль 0 0 -46
б) СаСО3 (к) = СаО (к) + СО2 (г)
ΔН0f,298, кДж/моль -1207 -635 -393
ΔS0f,298, кДж/моль 93 40 214
Вычислите ΔS0f,298, ΔG0f,298 реакции разложения карбоната кальция. Определите, возможна ли реакция при 298 K.
Рассчитайте температуру, при которой процесс разложения СаСО3может протекать произвольно.
Скачать решение задачи 64 (методичка 120в) 90р
Задача №65.
Для сравнения энергетических эффектов различных процессов расчеты относят к условиям, принятым за стандартные. Какие условия считаются стандартными? Какую информацию содержат обозначения: ΔH0f,298, ΔS0f,298, ΔG0f,298, ΔH0f,298, ΔG0f,298,
Вычислите ΔH0f,298 реакции, протекающей в термите (термит-порошкообразная семь алюминия и оксида менее активного металла (Fe, Mn и др.))
3Fe3O4(к) + 8Al(к) = 4Al2O3(к) + 9Fe(к)
ΔН0f,298, кДж/моль -1117 0 -1676 0
ΔS0f,298, кДж/моль 146 28 51 27
Составьте термохимическое уравнение реакции (обратите внимание на величину теплового эффекта реакции).
Пользуясь значениями ΔH0f,298, ΔS0f,298, ΔG0f,298 объясните, может ли приведенная реакция протекать самопроизвольно в стандартных условиях?
Скачать решение задачи 65 (методичка 120в) 90р
Задача №66.
Что понимают под стандартной молярной энтальпией образования веществ ΔH0f,298?
Используя значения ΔH0f,298 веществ, рассчитайте изменение энтальпии реакции
3Fe3O4(к) + CO(г) = 3FeO(к) + CO2(г)
ΔН0f,298, кДж/моль -1117 110 -265 -393
ΔS0f,298, кДж/моль 146 197 61 214
а) вычислите ΔG0f,298 процесса и сделайте вывод о возможности его самопроизвольного протекания в стандартных условиях.
б) определите температуру, при которой этот процесс становится самопроизвольным.
Скачать решение задачи 66 (методичка 120в) 90р
Задача №67.
Согласно закону Гесса, тепловой эффект реакции равен сумме молярных энтальпий образования продуктов реакции за вычетом суммы молярных энтальпий образования исходных веществ (с учетом стехиометрических коэффициентов).
Для стандартных условий
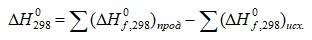
Вычислите реакции ΔН0f,298
4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(г)
ΔН0f,298, кДж/моль -46 0 90 -242
ΔS0f,298, кДж/моль 193 205 211 189
и составьте ее термохимическое уравнение.
Определите вклад энтальпийного (ΔН) и энтропийного (TΔS) факторов в осуществление приведенной реакции.
Объясните, почему данных процесс необратим. При ответе используйте значения ΔH0f,298, ΔS0f,298, ΔG0f,298
Скачать решение задачи 67 (методичка 120в) 90р
Задача №68.
Что понимают под стандартной молярной энтропией? В каких единицах оно измеряется?
Выскажите предположение о характере изменения энтропии (ΔS>0, ΔS<0, ΔS=0)) в процессах:
2KClO3(к) = 2KCl(к) + 3O2(г) ΔH0f,298 =-90
ΔS0f,298, кДж/моль 143 83 205
2С2H2(г) + 5О2(г) = 4СO2(г) + 2Н2О
ΔS0f,298, кДж/моль 201 205 214 70
С(графит) + O2(г) = CO2(г)
ΔS0f,298, кДж/моль 6 205 214
Для обоснования ответа рассчитайте изменение энтропии в этих реакциях.
Отметьте, какую информацию содержит уравнение реакции разложения KClO3. Вычислите ΔG0f,298 данной реакции. Будет ли она самопроизвольно протекать в стандартных условиях?
Скачать решение задачи 68 (методичка 120в) 90р
Задача №69.
Энтропию можно рассматривать как меру «беспорядка» (неупорядоченности) системы. Сравните значения стандартной молярной энтропии воды в газовом, жидком и кристаллическом состояниях:
H2O(г) Н2О(ж) Н2О(к)
ΔS0f,298, кДж/моль 189 70 39
Объясните различия значений ΔS0f,298, воды в ее различных агрегатных состояниях.
Вычислите изменения энтропии и энергии Гиббса реакции:
Fe2O3(к) + 3H2(г) = 2Fe(к) + 3H2O(г) ΔH0f,298 =96
ΔS0f,298, кДж/моль 87 130 27 189
и определить возможность ее осуществления в стандартных условиях.
Скачать решение задачи 69 (методичка 120в) 90р
Задача №70.
1. Энтропия является количественной мерой беспорядка в системе. Энтропия растет при плавлении твердого вещества и превращении жидкости в пар, при процессах растворения кристаллического вещества и в химических реакциях, протекающих с увеличением объема. Процессы, связанные с ростом упорядоченности системы (охлаждение, конденсация, кристаллизация из раствора, сжатие и пр.) сопровождаются уменьшением энтропии. Чем тверже вещество, тем меньше его энтропия.
Объясните: а) какой из металлов является более мягким?
Be Mg Ca
ΔS0f,298, кДж/моль 9,5 32,7 41,6
б) почему стандартная молярная энтропия у алмаза меньше (2,3 Дж/К ⋅ моль), чем у графита (5,7 Дж/К ⋅ моль)?
2. Отметьте, какую информацию содержит уравнение
2Pb(к) + O2(г) = 2PbO(к) ΔH0f,298 = -438 кДж
ΔS0f,298, кДж/моль 65 205 66
Рассчитайте ΔS0f,298, ΔG0f,298, данной реакции и определите осуществима ли она в стандартных условиях.
Скачать решение задачи 70 (методичка 120в) 90р
Задача №71.
Энтропия возрастает (ΔS>0) при переходе системы из более упорядоченного состояния в менее упорядоченное и, наоборот, переход системы из менее упорядоченного состояния в более упорядоченное связан с уменьшением энтропии (ΔS<0).
Объясните характер изменения энтропии (ΔS>0, ΔS<0, ΔS=0) в следующих превращениях:
(NH4)2CO3(к) = 2NH3(г) + СO2(г) + H2O(г)
2HCl(г) = H2(г) + Cl2(г)
PCl3(г) + Cl2(г) = PCl3(г)
ΔН0f,298, кДж/моль -287 0 -366
ΔS0f,298, кДж/моль 312 223 365
С(графит) + O2(г) = CO2(г)
ΔS0f,298, кДж/моль 6 205 214
PCl5(г) = Cl2(г) + PCl3(г)
Вычислите ΔH0f,298, ΔS0f,298, ΔG0f,298 последней реакции.
а) определите вероятность ее протекания в стандартных условиях.
б) рассчитайте температуру начала разложения хлорида фосфора (V).
Скачать решение задачи 71 (методичка 120в) 90р
Задача №72
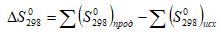
Изменение энтропии системы зависит от ее начального и конечного состояний. Изменение энтропии при химических реакциях равно сумме энтропии продуктов реакции за вычетом суммы энтропии исходных веществ (с учетом стехиометрических коэффициентов).
Для стандартных условий изменение энтропии имеет вид.
Вычислите изменение энтропии в реакциях:
2С2H2(г) + 5O2(г) = 4СO2(г) + 2H2O(ж)
ΔН0f,298, кДж/моль 227 0 -393 -286
ΔS0f,298, кДж/моль 201 205 214 70
COCl2(г) = СO2(г) + Cl2(г)
ΔS0f,298, кДж/моль 284 214 223
С(графит) + O2(г) = CO2(г)
ΔS0f,298, кДж/моль 6 205 214
Рассчитайте ΔH0f,298, ΔS0f,298, для первой реакции и установите, будет ли она самопроизвольной в стандартных условиях.
Скачать решение задачи 72 (методичка 120в) 90р
Задача №73.
В самопроизвольно протекающих процессах действуют две тенденции: а) стремление частиц к объединению за счет образования более прочных связей, что сопровождается уменьшением энтальпии (ΔH<0);
б) стремление частиц к разъединению, что увеличивает энтропию ΔS>0.
Суммарный эффект этих противоположных тенденций отражает изменение энергии Гиббса.
Рассчитайте изменение энергии Гиббса ΔG0f,298 реакции:
C(графит,к) + 2H2(г) = CH4(г)
ΔН0f,298, кДж/моль 0 0 75
ΔS0f,298, кДж/моль 6 130 186
рассчитав предварительно значения ΔH0f,298, ΔG0f,298
Установите, осуществима ли эта реакция в стандартных условиях. Отметьте, какой фактор – энтальпийный ΔH или энтропийный TΔS - определяет возможность самопроизвольного протекания прямой реакции? Объясните, может ли повышение температуры изменить направление реакции?
Скачать решение задачи 73 (методичка 120в) 90р
Задача №74.
Прокомментируйте утверждение, что характер изменения энергии Гиббса, является критерием направления протекания химической реакции.
Проиллюстрируйте использование ΔG0f,298 для возможности протекания реакции разложения карбоната магния в стандартных условиях.
MgCO3(к) = MgO(k) + CO2(к)
ΔН0f,298, кДж/моль -1113 -602 -293
ΔS0f,298, кДж/моль 66 27 214
Рассчитайте изменение энергии Гиббса, используя значения и ΔH0f,298, ΔS0f,298. Определите значение температуры, при которой становится возможной термическая диссоциация карбоната магния.
Скачать решение задачи 74 (методичка 120в) 90р
Задача №75.
Справедливо ли утверждение, что изменение свободной энергии Гиббса является критерием самопроизвольности протекания процесса?
Обоснуйте, могу ли реакции
N2(г) + O2(г) = 2NO(г) ΔH0f,298 = 180 кДж ΔS0f,298 = 17 кДж
NH3(г) + HCl(г) = NH4Cl(k)
ΔН0f,298, кДж/моль -47 -92 -314
ΔS0f,298, кДж/моль 193 187 96
Идти самопроизвольно в стандартных условиях. Вычислите ΔG0f,298,
реакции, используя значения ΔH0f,298, ΔS0f,298,
Поясните, какой фактор – энтальпийный (ΔH) или энтропийный TΔS, определяет знак ΔG0f,298 реакции образования хлорида аммония? Экзо- или эндотермическим процессом является эта реакция?
Скачать решение задачи 75 (методичка 120в) 90р
Задача №76.
Сформулируйте понятие стандартной молярной энергии Гиббса образования вещества.
По известным значениям ΔG0f,298 рассчитайте изменения энергии Гиббса (ΔG0298) следующих процессов:
TiO2(k) + 2C(k) = Ti(k) + 2CO(г)
ΔG0f,298, кДж/моль -889 0 0 -137
CH4(г) + 2O2(г) = СO2(г) + 2H2O(ж)
ΔG0f,298, кДж/моль -51 0 -394 -237
ΔH0f,298, кДж/моль -75 0 -393 -286
C2H4(г) + 3O2(г) = 2СO2(г) + 2H2O(ж)
ΔG0f,298, кДж/моль 68 0 -394 -237
ΔH0f,298, кДж/моль 52 0 -393 -286
Отметьте будут ли они протекать самопроизвольно в стандартных условиях.
Составьте термохимические уравнения реакции горения метана и этилена. Какое из этих веществ наиболее выгодно использовать в качестве топлива?
Скачать решение задачи 76 (методичка 120в) 90р
Задача №77.
Согласно закону Гесса, изменение энергии Гиббса реакции равно сумме молярных энергий Гиббса образования продуктов реакции за вычетом суммы молярных энергий Гиббса образования исходных веществ (с учетом стехиометрических коэффициентов) Для стандартных условий
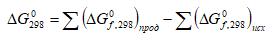
На основе значений ΔG0f,298 рассчитайте изменение энергии Гиббса в системе
CH4(г) + CO2(г) = 2СO(г) + 2H2(г)
ΔH0f,298, кДж/моль -75 -393 -110 0
ΔS0f,298, кДж/моль 186 214 198 130
ΔG0f,298, кДж/моль -51 -394 -137 0
Проведя соответствующие расчеты, обсудите вопросы:
1. Возможно ли самопроизвольное протекание прямой реакции при 25°C?
2. Экзо- или эндотермической является реакция?
3. Уменьшится или увеличится энтропия (ΔS<0 или ΔS>0) в данном процессе?
4. Энтальпийный (ΔH) или энтропийный (TΔS) фактор определяет значение ΔG0f,298?
Скачать решение задачи 77 (методичка 120в) 90р
Задача №78.
Изменение энергии Гиббса зависит от изменения энтальпии, энтропии и температуры:
ΔG = ΔH - TΔS
Соотношений значений ΔH (энтальпийный фактор) и TΔS (энтропийный фактор) определяет направление (прямое или обратное) течение химического процесса:
1. ΔH<0, ΔS>0, ΔG<0 - прямая реакция возможна при любой температуре.
2. ΔH<0, ΔS<0, ΔG<0 - прямая реакция возможна при низкой температуре.
3 ΔH>0, ΔS>0, ΔG<0 - прямая реакция возможна при высокой температуре.
4. ΔH>0, ΔS<0, ΔG>0 - обратная реакция возможна при любой температуре.
Для приведенных процессов:
4NH3(г) + 3О2(г) = 2N2(г) + 6H2O(г)
4NH3(г) + 5О2(г) = 4NО(г) + 6H2O(г)
ΔH0f,298, кДж/моль -46 0 90 -242
ΔS0f,298, кДж/моль 193 205 211 189
Определите:
1) какая из реакций окисления аммиака термодинамически наиболее вероятна?
2) обратима ли реакция окисления аммиака кислородом, осуществляемая в производстве азотной кислоты?
Скачать решение задачи 78 (методичка 120в) 90р
Задача №79.
Как вы понимаете утверждение, что свободная энергия Гиббса образования химического соединения является мерой устойчивости этого соединения?
Рассчитайте изменения энергии Гиббса реакции:
H2(г) + F2(г) = 2HF(г)
ΔG0f,298, кДж/моль 0 0 -273
H2(г) + Cl2(г) = 2HCl(г)
ΔG0f,298, кДж/моль 0 0 -95
ΔH0f,298, кДж/моль 0 0 -95
ΔS0f,298, кДж/моль 130 223 187
H2(г) + Br2(г) = 2HBr(г)
ΔG0f,298, кДж/моль 0 0 -51
H2(г) + I2(г) = 2HI(г)
ΔG0f,298, кДж/моль 0 0 2
и установите: а) какая из них в стандартных условиях термодинамически наиболее вероятна; б) какое из образовавшихся веществ является наиболее устойчивым (заметим, что положительное значение ΔG0298 в реакции образования HI свидетельствует о том, что данное соединение малоустойчиво и легко разлагается на H2 и I2).
Для реакции синтеза рассчитайте ΔH0f,298, ΔS0f,298
а) сопоставьте абсолютные значения ΔH и TΔS, сделайте заключение о влияние энтальпийного и энтропийного факторов ΔG0298
б) установите, является ли данная реакция экзо- или эндотермической
Скачать решение задачи 79 (методичка 120в) 90р
Задача №80.
На основе значений ΔH0f,298, ΔS0f,298 и ΔG0f,298 определите, какие из приведенных реакций термодинамически более вероятны в стандартных условиях:
TiO3(k) + 3C(графит) = TiC(k) + 2CO(г)
TiO2(k) + 2C(графит) = Ti(k) + 2CO(г)
TiO2(k) + 2Cl(г) = TiCl4(ж) + O2(г)
TiO2(k) + 2Cl2(г) = TiCl4(ж) + 2CO(г)
TiO2(k) TiC(k) Ti(k) TiCl4(ж) С(граф) СО(г) Сl2(г) С2(г)
ΔH0f,298, кДж/моль -944 -209 0 -804 0 -110 0 0
ΔS0f,298, кДж/моль 50 25 31 252 6 197 223 205
Обсудите: а) как повлияет повышение температуры на вероятность осуществления каждой из реакций.
б) почему при промышленном способе получения титана диоксид титана превращают в (последняя реакция)? Далее получают титан по схеме:
TiCl4 + Mg = MgCl2+ Ti
Скачать решение задачи 80 (методичка 120в) 90р
Задача №81.
Сущность процесса гидролиза карбоната натрия выразите записью ионного уравнения.
Na2CO3 + H2O = NaHCO3 + NaOH
Приведите выражение константы гидролиза по карбонат-иону.
Определите направление смещения равновесия гидролиза при увеличении концентрации в растворе гидроксид-ионов.
Вычислите концентрацию (моль/л) гидроксид-ионов в растворе, имеющем pH = 12,0.
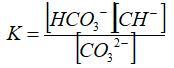
Скачать решение задачи 81 (методичка 120в) 90р
Задача №82.
Сущность процесса гидролиза сульфида калия выразите записью ионного уравнения.
K2S + H2O = KHS + KOH
Приведите выражение константы гидролиза по сульфид-иону.
Определите направление смещения равновесия гидролиза при уменьшении концентрации гидроксид-ионов.
Вычислите концентрацию (моль/л) ионов водорода в растворе, имеющем pH = 10,0.
Скачать решение задачи 82 (методичка 120в) 90р
Задача №83.
Сущность процесса гидролиза хлорида цинка выразите записью ионного уравнения.
ZnCl2 + H2O = ZnOHCl + HCl
Приведите выражение константы гидролиза по иону Zn (II).
Определите направление смещения равновесия гидролиза при увеличении в системе концентрации ионов водорода.
Вычислите концентрацию (моль/л) гидроксид-ионов в растворе со значением pH = 4,0.
Скачать решение задачи 83 (методичка 120в) 90р
Задача №84.
Сущность процесса гидролиза сульфата алюминия выразите записью ионного уравнения.
Al2(SO4)3 + H2O = 2AlOHSO4 + H2SO4
Приведите выражение константы гидролиза по иону Al (III).
Определите направление смещения равновесия гидролиза при уменьшении концентрации ионов водорода в растворе.
Вычислите концентрацию (моль/л) ионов водорода в растворе, имеющем pH = 9,0.
Скачать решение задачи 84 (методичка 120в) 90р
Задача №85.
Приведите выражение константы гидролиза по сульфат (IV)-иону:
SO32- + HOH = HSO3- + OH-
Определите направление смещения равновесия гидролиза по SO32- -иону при увеличении концентрации гидроксид-ионов в растворе.
Выразите гидролиз молекулярным уравнением
Укажите pH раствора с концентрацией гидроксид-ионов 1*10-9 моль/л.
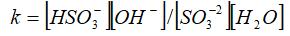
Скачать решение задачи 85 (методичка 120в) 90р
Задача №86.
Приведите выражение константы гидролиза по силикат-иону:
SiO32- + HOH = HSiO3- + OH-
Определите направление смещения равновесия гидролиза по SiO32- - иону при уменьшении в растворе концентрации гидроксид ионов.
Запишите уравнение гидролиза в молекулярной форме.
Укажите pH раствора с концентрацией гидроксид-ионов 1*10-9 моль/л.
Скачать решение задачи 86 (методичка 120в) 90р
Задача №87.
Приведите выражение константы гидролиза с участие ионов Ni (II):
Ni2+ + HOH = NiOH+ + H+
Определите направление смещения равновесия гидролиза по иону Ni (II) при увеличении в системе концентрации ионов водорода.
Выразите гидролиз молекулярным уравнением.
Какой из растворов является кислым, щелочным или нейтральным при концентрации (моль/л) ионов водорода: а) 1*10-7, б) 1*10-3 в) 1*10-8
Скачать решение задачи 87 (методичка 120в) 90р
Задача №88.
Уравнение
2AlCl3 + 3Na2CO3 + 6H2O = 2Al(OH)3 + 3H2CO3 + 6NaCl
отражает процесс полного гидролиза (гидролиз по катиону и аниону).
Покажите сущность данной реакции записью ионного уравнения.
Возможно ли образование сульфида хрома (III) по обменной реакции в водном растворе?
Вычислите концентрации (моль/л.) ионов водорода и гидроксид - ионов в растворе, имеющем рН = 5,0.
Скачать решение задачи 88 (методичка 120в) 90р
Задача №89.
Составьте уравнение гидролиза сульфата меди (II). Покажите сущность процесса записью ионного уравнения.
Приведите выражение константы гидролиза по иону Cu (II).
Определите направление смещения равновесия гидролиза пол влиянием одноименных ионов.
Укажите pH раствора, имеющего концентрацию гидроксид-ионов 1*10-10моль/л.
Скачать решение задачи 89 (методичка 120в) 90р
Задача №90.
Составьте уравнение гидролиза нитрата свинца (II). Покажите сущность процесса записью ионного уравнения.
Приведите выражение константы гидролиза по иону Pb (II). Определите направление смещения равновесия гидролиза при разбавлении раствора.
Какой из растворов является кислым, если концентрация (моль/л) ионов водорода составляют: а) 1*10-3, б) 1*10-7 в) 1*10-11 ?
Скачать решение задачи 90 (методичка 120в) 90р
