Методичка 140 вопросов
Решение задач 1-35 (методичка 140)
Задание 1
Перечислите положения квантовой (волновой) механики, на которых основана теория строения электронной оболочки атома.
Прокомментируйте фразу: «Квантовый характер излучения и поглощения энергии системой микрочастиц».
Приведите электронную конфигурацию атома марганца и иона марганца (II) в основном состоянии.
Назовите число орбиталей атома марганца, имеющих в основном состоянии атома по одному электрону.
Охарактеризуйте набором квантовых чисел каждую из 3d-орбиталей.
Какое число электронов атома может находиться в 3d-состоянии?
Скачать решение задания 1 (методичка 140в) 50р
Задание 2
Перечислите положения квантовой (волновой) механики, на которых основана теория строения атома.
Прокомментируйте фразу: «Волновой характер движения микрочастиц»
Приведите электронную конфигурацию атома германия.
Составьте энергетическую схему распределения по орбиталям электронов атома германия.
Охарактеризуйте набором квантовых чисел 4 s – орбиталь.
Какое максимальное число электронов может находиться в энергетическом 5 s – состоянии?
Скачать решение задания 2 (методичка 140в) 50р
Задание 3
Перечислите представления квантовой механики, на которых основана теория строения атома.
Приведите электронную конфигурацию атома технеция в основном состоянии.
Назовите число орбиталей атома технеция, имеющих в основном со-стоянии атома по одному электрону.
Охарактеризуйте набором квантовых чисел каждую из 4d-орбиталей.
Какое максимальное число электронов может находиться в 4d-состоянии?
Скачать решение задания 3 (методичка 140в) 50р
Задание 4
На основе представлений квантовой механики сформулируйте понятие «электронное облако»
Приведите электронную конфигурацию атома индия и иона индия (III). Составьте энергетическую схему распределения по орбиталям электронов атома индия.
Какое максимальное число электронов может находиться в 5 p–состоянии?
Скачать решение задания 4 (методичка 140в) 50р
Задание 5
Как Вы представляете модель движения электрона в атоме?
Нарисуйте расположение одной s- и трех р-орбиталей относительно осей координат.
Опишите форму орбитали, характеризующейся квантовыми числами: n = 6; l = 0; ml = 0.
Приведите электронную конфигурацию атома цезия и иона цезия (I) в основном состоянии.
Составьте энергетическую схему распределения по орбиталям электронов атома цезия.
Охарактеризуйте набором квантовых чисел каждую из 5p-орбиталей.
Какое число электронов может находиться в энергетическом 6s-состоянии?
Скачать решение задания 5 (методичка 140в) 50р
Задание 6
На основе представлений квантовой механики сформулируйте понятие «орбиталь».
Какую форму имеет s-орбиталь; р-орбиталь? Нарисуйте их модели.
Приведите электронную конфигурацию атома брома и бромид-иона.
Составьте энергетическую схему распределения по орбиталям электронов атома брома.
Охарактеризуйте набором квантовых чисел каждую из 4р-орбиталей.
Какое максимальное число электронов может находиться в энергетическом 4р-состоянии?
Скачать решение задания 6 (методичка 140в) 50р
Задание 7
Сформулируйте понятие «орбиталь». Нарисуйте модели d-орбиталей. Приведите их буквенные обозначения.
Составьте электронную конфигурацию атома ванадия.
Назовите число 3d-орбиталей атома ванадия, не заполняемых электронами атома в основном состоянии.
Назовите суммарное спиновое число электронов 3d-состояния атома ванадия.
Охарактеризуйте набором квантовых чисел 4s-орбиталь.
Скачать решение задания 7 (методичка 140в) 50р
Задание 8
Известно, что состояние электрона в атоме можно описать с помощью набора квантовых чисел. Назовите и обозначьте квантовые числа, обоснуйте применение каждого из них.
Приведите электронную конфигурацию атома рутения в основном состоянии.
Назовите число орбиталей атома рутения, имеющих в основном состоянии по одному электрону.
Охарактеризуйте набором квантовых чисел 3s-орбиталь.
Скачать решение задания 8 (методичка 140в) 50р
Задание 9
Приведите обозначение главного квантового числа, обоснуйте его применение.
Укажите схему, отражающую верное распределение электронов по s- и р-орбиталям внешнего слоя атома таллия:
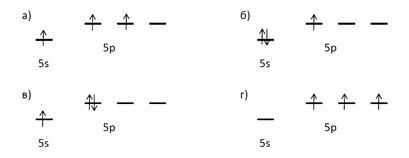
Дайте пояснения к ответу.
Составьте электронную конфигурацию иона таллия (I).
Какое максимальное число электронов может находиться в энергетическом 6р-состоянии?
Охарактеризуйте набором квантовых чисел каждую из 6р-орбиталей.
Скачать решение задания 9 (методичка 140в) 50р
Задание 10
Сформулируйте понятия: «энергетический уровень» (квантовый слой), «энергетический подуровень» (подслой).
Приведите электронную конфигурацию атома гафния в основном состоянии.
Составьте энергетическую схему распределения по орбиталям электронов атома гафния.
Какое максимальное число электронов может находиться в энергетическом 5d- состоянии?
Охарактеризуйте набором квантовых чисел 1s-орбиталь.
Скачать решение задания 10 (методичка 140в) 50р
Задание 11
Приведите обозначение орбитального квантового числа, охарактеризуйте его применение.
Какие значения принимает орбитальное квантовое число для данного главного квантового числа: а) n = 1, б) n = 2?
Атом какого элемента имеет электронную конфигурацию: 1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p4?
Дайте пояснения.
Назовите число орбиталей данного атома, имеющих в основном состоянии по одному электрону.
Скачать решение задания 11 (методичка 140в) 50р
Задание 12
Какие значения принимает орбитальное квантовое число для данного главного квантового числа: а) n = 3, б) n = 4?
Составьте энергетическую схему распределения по орбиталям электронов атома кобальта.
Обоснуйте, какая из электронных конфигураций соответствует иону кобальта (II): a) 1s22s22p63s23p63d54s2, б) 1s22s22p63s23p63d74s2, в) 1s22s22p63s23p63d74s0.
Назовите суммарное спиновое число 3d-электронов атома кобальта.
Какое квантовое число определяет число орбиталей d-подуровня?
Скачать решение задания 12 (методичка 140в) 50р
Задание 13
Приведите обозначение магнитного квантового числа, обоснуйте его применение.
Укажите число орбиталей, описываемых орбитальным квантовым числом: а) l = 0, б) l = 1.
Приведите электронную конфигурацию: а) атома йода, б) йодид-иона в основном состоянии.
Составьте энергетическую схему распределения по орбиталям электронов атома йода.
Охарактеризуйте набором квантовых чисел каждую из 5d-орбиталей.
Какое максимальное число электронов может находиться в энергетическом 5d-состоянии?
Скачать решение задания 13 (методичка 140в) 50р
Задание 14
Расскажите об использовании магнитного квантового числа для описания состояния электрона в атоме.
Опишите форму орбитали, характеризующейся квантовыми числами: n=3, l = 1, ml= 0, ±1.
Нарисуйте расположение трех р-орбиталей вдоль осей координат.
Приведите электронную конфигурацию: а) атома теллура, б) теллурид-иона в основном состоянии.
Какая из нижеприведенных схем отражает верное распределение электронов атома теллура по s-и р-орбиталям внешнего слоя?

Дайте пояснения к ответу.
Какое максимальное число электронов может находиться в энергетическом 6d-состоянии?
Скачать решение задания 14 (методичка 140в) 50р
Задание 15
Укажите число орбиталей, характеризующихся орбитальным квантовым числом:
а) l=2
б) l=3
Приведите электронную конфигурацию атома осмия;
Составьте энергетическую схему распределения по орбиталям электронов атома осмия;
Назовите число орбиталей атома осмия, имеющих в основном состоянии атома по одному электрону;
Охарактеризуйте набором квантовых чисел каждую из 4f-орбиталей;
Какое максимальное число электронов может находиться в энергетическом 4f-состоянии?
Скачать решение задания 15 (методичка 140в) 50р
Задание 16
Приведите обозначение спинового квантового числа; обоснуйте его применение.
Атом какого элемента имеет электронную конфигурацию: 1s22s22p63s23p63dl04s24p64d104f145s25p65d106s26p2? Дайте пояснения к ответу.
Составьте энергетическую схему распределения по орбиталям внешнего слоя электронов атома свинца в основном состоянии.
Охарактеризуйте набором квантовых чисел каждую из 6р-орбиталей.
Какое максимальное число электронов может находиться в энергетическом 6р-состоянии?
Скачать решение задания 16 (методичка 140в) 50р
Задание 17
Известно, что при составлении электронной конфигурации атома учитывается принцип наименьшей энергии. Поясните, как согласно принципу наименьшей энергии, происходит заполнение электронными орбиталями атома олова.
Приведите электронную конфигурацию: а) атома олова и б) иона олова (II).
Охарактеризуйте набором квантовых чисел 7 s – орбиталь.
Какое максимальное число электронов может находиться в энергетическом 7 s- состоянии?
Скачать решение задания 17 (методичка 140в) 50р
Задание 18
Сформулируйте принцип Паули.
Какое максимальное число электронов может находиться в энергетических состояниях 1s, 2p, 3d, 4f?
Охарактеризуйте набором квантовых чисел каждую из 5f-орбиталей?
Приведите электронную конфигурацию: а) атома висмута, б) иона висмута (III) в основном состоянии.
Поясните, как согласно принципу Паули, происходит заполнение электронами орбиталей внешнего слоя атома висмута.
Скачать решение задания 18 (методичка 140в) 50р
Задание 19
Сформулируйте правило Хунда,
Атом какого элемента имеет электронную конфигурацию:
1s22s22p63s23p63d84s2
Поясните, как согласно правилу Хунда происходит заполнение электронами 3d- и 4s- орбиталей атома никеля.
Какое максимальное число электронов может находиться в энергетическом 3d - состоянии?
Опишите форму орбитали, характеризующейся квантовыми числами:
Скачать решение задания 19 (методичка 140в) 50р
Задача 20
Опишите форму орбитали, характеризующейся квантовыми числами: n = 4; l = 1, ml = 0, 1
Приведите электронную конфигурацию атома полония.
Составьте энергетическую схему распределения по орбиталям электронов атома полония.
Назовите суммарное спиновое число р-электронов внешнего слоя атома полония.
Какое максимальное число электронов может находиться в энергетическом 6d-состоянии?
Скачать решение задания 20 (методичка 140в) 50р
Задание 21
Постройте график зависимости значений атомной массы от порядкового номера элементов первого, второго и третьего периодов. Обоснуйте, почему атомная масса не является периодическим свойством элементов. Перечислите свойства элементов, которые носят периодический характер.
Скачать решение задания 21 (методичка 140в) 50р
Задание 22
Приведите валентные электронные конфигурации атомов ванадия и мышьяка. Сравните значения первой энергии ионизации атомов ванадия и мышьяка. Сделайте вывод, какому из этих элементов присущи металлические признаки в большей степени.
Скачать решение задания 22 (методичка 140в) 50р
Задание 23
Почему марганец и бром помещают в одну группу, но разные подгруппы периодической системы? В чем сходство и различие в химии этих элементов? Какие степени окисления наиболее устойчивы для: а) брома, б) марганца? Приведите формулы оксидов этих элементов в высших степенях окисления.
Скачать решение задания 23 (методичка 140в) 50р
Задание 24
Объясните особенности строения VIII группы периодической системы. Обоснуйте положение кобальта и никеля в этой группе, а также близость свойств триады железа. В обоснование ответа приведите валентные электронные конфигурации атомов, значения ra, Fu и примеры соединений в устойчивых степенях окисления.
Скачать решение задания 24 (методичка 140в) 50р
Задание 25
С какими элементами образует бинарные соединения водород в степени окисления –1? Приведите ряд гидридов элементов 2-го и 3-го периодов.
Скачать решение задания 25 (методичка 140в) 50р
Задание 26
Значения первой энергии ионизации атомов натрия и магния равны соответственно 495,8 и 737,7 кДж/моль, а значения второй энергии ионизации – 4565 и 1451 кДж/моль. Как можно объяснить резкое увеличение второй энергии ионизации атома натрия по сравнению с атомом магния? В обоснование ответа приведите электронные конфигурации этих атомов.
Скачать решение задания 26 (методичка 140в) 50р
Задание 27
Приведите валентные электронные конфигурации атомов семейства d-элементов 4-го периода. Какие свойства (металлов или неметаллов) проявляют простые вещества этих элементов? В обоснование ответа рассмотрите закономерности изменения первой энергии ионизации атомов в ряду К – Zn.
Скачать решение задания 27 (методичка 140в) 50р
Задание 28
На примере II группы покажите, на какие подгруппы и по какому принципу подразделяют элементы группы? Приведите валентные электронные конфигурации атомов. На примере элементов подгруппы кальция покажите вертикальное сходство в химии этих элементов. Приведите формулы их оксидов и гидроксидов. Как изменяются кислотно-основные свойства соединений этих элементов в подгруппе?
Скачать решение задания 8 (методичка 140в) 50р
Задание 29
Рассмотрите тенденции изменения 1) атомного радиуса, 2) энергии ионизации и 3) сродства к электрону элементов 3-го периода? Как изменяются свойства простых веществ этих элементов в периоде с увеличением порядкового номера? Приведите наиболее характерные степени окисления для элементов начала и конца периода.
Скачать решение задания 29 (методичка 140в) 50р
Задание 30
Дайте определение энергии сродства к электрону атома. Какова общая тенденция изменения сродства к электрону атомов: по периоду, в группах периодической системы? Почему сродство к электрону атомов гелия, азота, неона, магния близко к нулю? В обоснование ответа приведите валентные электронные конфигурации атомов этих элементов.
Скачать решение задания 30 (методичка 140в) 50р
Задание 31
Возможно ли существование отрицательно заряженных ионов Э– в невозбужденном состоянии следующих элементов: водорода; щелочных металлов; бериллия? Ответ обоснуйте.
Скачать решение задания 31 (методичка 140в) 50р
Задание 32
Приведите валентные электронные конфигурации атомов элементов V группы. На какие подгруппы можно поделить эту группу? Рассмотрите общие тенденции изменения атомного радиуса и энергии ионизации в подгруппах. У какого элемента подгруппы мышьяка сильнее выражены металлические свойства?
Скачать решение задания 32 (методичка 140в) 50р
Задание 33
Постройте графики зависимости изменения первой энергии ионизации и радиуса атомов р-элементов III группы от заряда ядра. Как можно объяснить немонотонный характер этих зависимостей?
B Al Ga In Tl
rорб, нм 0,078 0,126 0,126 0,138 0,132
Еи, эВ 8,298 5,98 6,09 5,78 6,11
Являются ли эти элементы полными электронными аналогами?
Скачать решение задания 33 (методичка 140в) 50р
Задание 34
Большинство элементов в периодической системе занимают места в порядке возрастания их атомной массы. Однако есть элементы, которые нарушают этот порядок. К ним относятся аргон и калий (порядковые номера 18 и 19), кобальт и никель (27 и 28), теллур и йод (52 и 53), протактиний и торий (90 и 91). Как можно объяснить этот факт? Какова современная формулировка периодического закона?
Скачать решение задания 34 (методичка 140в) 50р
Задание 35
Почему водород часто помещают как в первую, так и в седьмую группу периодической системы? Приведите электронную конфигурацию атома водорода и возможные степени окисления. Приведите ряд соединений водорода с элементами второго периода и укажите степени окисления элементов.
Скачать решение задания 35 (методичка 140в) 50р
Решение задач 36-70 (методичка 140)
Задание 36
Рассмотрите зависимость изменения первой энергии ионизации от заряда ядра в ряду d-элементов 4-го периода (рис. 2.2). Отрыву какого электрона (3d- или 4s-подуровня) отвечают данные значения Eи? Объясните характер изменения энергии ионизации в этом ряду элементов.
Скачать решение задания 36 (методичка 140в) 50р
Задание 37
Дайте определение относительной электроотрицательности. Пользуясь шкалой электроотрицательностей Полинга, составьте формулы нитридов элементов второго и третьего периодов. Какую степень окисления можно приписать азоту в
Скачать решение задания 37 (методичка 140в) 50р
Задание 38
Приведите валентные электронные конфигурации элементов подгруппы меди. К каким элементам (s-, р- или d-) они относятся? Являются ли эти элементы полными электронными аналогами? Объясните изменение энергии ионизации в ряду Cu–Ag–Au.
Скачать решение задания 38 (методичка 140в) 50р
Задание 39
На какие подгруппы подразделяют элементы восьмой группы? Приведите валентные электронные конфигурации элементов главной подгруппы. Почему гелий относят к данной подгруппе? На основании закономерностей изменения энергии ионизации в периоде и энергии сродства к электрону объясните свойства инертных газов.
Скачать решение задания 39 (методичка 140в) 50р
Задание 40
Постройте графики зависимости радиусов и энергии ионизации атомов от заряда ядра для d-элементов IV группы. Чем объясняется близость атомных радиусов и значений энергий ионизации циркония и гафния и как это отражается на свойствах этих элементов?
Ti Zr Hf Ки
rмет ,нм 0,146 0,160 0,159 0,160
rион Э4+ , нм 0,064 0,082 0,082 0,078
Еи,эВ 6,28 6,84 7,50 -
Задание 41
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
Cl2 |
CN+ |
K2 |
|
Пользуясь методом МО:
а) постройте энергетическую диаграмму молекулярных орбиталей частицы*;
б) распределите валентные электроны по энергетическим уровням частицы на диаграмме;
в) напишите реакцию образования частицы из ее составляющих;
г) определите порядок связи в частице;
д) установите, пара- или диамагнитна ли частица.
Скачать решение задания 41 (методичка 140в) 50р
Задание 42
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
Zn2 |
Ne+ |
CF |
|
Пользуясь методом МО:
а) постройте энергетическую диаграмму молекулярных орбиталей частицы*;
б) распределите валентные электроны по энергетическим уровням частицы на диаграмме;
в) напишите реакцию образования частицы из ее составляющих;
г) определите порядок связи в частице;
д) установите, пара- или диамагнитна ли частица.
Скачать решение задания 42 (методичка 140в) 50р
Задание 43
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
I2 |
N4-2 |
BCl |
|
Пользуясь методом МО:
а) постройте энергетическую диаграмму молекулярных орбиталей частицы*;
б) распределите валентные электроны по энергетическим уровням частицы на диаграмме;
в) напишите реакцию образования частицы из ее составляющих;
г) определите порядок связи в частице;
д) установите, пара- или диамагнитна ли частица.
Скачать решение задания 43 (методичка 140в) 50р
Задание 44
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
N2 |
F+2 |
ClF |
|
Пользуясь методом МО:
а) постройте энергетическую диаграмму молекулярных орбиталей частицы*;
б) распределите валентные электроны по энергетическим уровням частицы на диаграмме;
в) напишите реакцию образования частицы из ее составляющих;
г) определите порядок связи в частице;
д) установите, пара- или диамагнитна ли частица.
Скачать решение задания 44 (методичка 140в) 50р
Задание 45
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
Si2 |
N2-2 |
CBr |
|
Пользуясь методом МО:
а) постройте энергетическую диаграмму молекулярных орбиталей частицы*;
б) распределите валентные электроны по энергетическим уровням частицы на диаграмме;
в) напишите реакцию образования частицы из ее составляющих;
г) определите порядок связи в частице;
д) установите, пара- или диамагнитна ли частица.
Скачать решение задания 45 (методичка 140в) 50р
Задание 46
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
O2 |
Cl+2 |
CO |
|
Пользуясь методом МО:
а) постройте энергетическую диаграмму молекулярных орбиталей частицы*;
б) распределите валентные электроны по энергетическим уровням частицы на диаграмме;
в) напишите реакцию образования частицы из ее составляющих;
г) определите порядок связи в частице;
д) установите, пара- или диамагнитна ли частица.
Скачать решение задания 46 (методичка 140в) 50р
Задание 47
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
C2 |
NO- |
Al2 |
|
Пользуясь методом МО:
а) постройте энергетическую диаграмму молекулярных орбиталей частицы*;
б) распределите валентные электроны по энергетическим уровням частицы на диаграмме;
в) напишите реакцию образования частицы из ее составляющих;
г) определите порядок связи в частице;
д) установите, пара- или диамагнитна ли частица.
Скачать решение задания 47 (методичка 140в) 50р
Задание 48
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
Na2 |
C-2 |
NO |
|
Пользуясь методом МО:
а) постройте энергетическую диаграмму молекулярных орбиталей частицы*;
б) распределите валентные электроны по энергетическим уровням частицы на диаграмме;
в) напишите реакцию образования частицы из ее составляющих;
г) определите порядок связи в частице;
д) установите, пара- или диамагнитна ли частица.
Скачать решение задания 48 (методичка 140в) 50р
Задание 49
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
Se2 |
B+2 |
CCl |
|
Пользуясь методом МО:
а) постройте энергетическую диаграмму молекулярных орбиталей частицы*;
б) распределите валентные электроны по энергетическим уровням частицы на диаграмме;
в) напишите реакцию образования частицы из ее составляющих;
г) определите порядок связи в частице;
д) установите, пара- или диамагнитна ли частица.
Скачать решение задания 49 (методичка 140в) 50р
Задание 50
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
F2 |
O+2 |
CN |
|
Пользуясь методом МО:
а) постройте энергетическую диаграмму молекулярных орбиталей частицы*;
б) распределите валентные электроны по энергетическим уровням частицы на диаграмме;
в) напишите реакцию образования частицы из ее составляющих;
г) определите порядок связи в частице;
д) установите, пара- или диамагнитна ли частица.
Скачать решение задания 50 (методичка 140в) 50р
Задание 51
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
Al2 |
NO+ |
CS |
|
Пользуясь методом МО:
а) постройте энергетическую диаграмму молекулярных орбиталей частицы*;
б) распределите валентные электроны по энергетическим уровням частицы на диаграмме;
в) напишите реакцию образования частицы из ее составляющих;
г) определите порядок связи в частице;
д) установите, пара- или диамагнитна ли частица.
Скачать решение задания 51 (методичка 140в) 50р
Задание 52
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
B2 |
N-2 |
BrF |
|
Пользуясь методом МО:
а) постройте энергетическую диаграмму молекулярных орбиталей частицы*;
б) распределите валентные электроны по энергетическим уровням частицы на диаграмме;
в) напишите реакцию образования частицы из ее составляющих;
г) определите порядок связи в частице;
д) установите, пара- или диамагнитна ли частица.
Скачать решение задания 52 (методичка 140в) 50р
Задание 53
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
Se2 |
CN- |
He2 |
|
Пользуясь методом МО:
а) постройте энергетическую диаграмму молекулярных орбиталей частицы*;
б) распределите валентные электроны по энергетическим уровням частицы на диаграмме;
в) напишите реакцию образования частицы из ее составляющих;
г) определите порядок связи в частице;
д) установите, пара- или диамагнитна ли частица.
Скачать решение задания 53 (методичка 140в) 50р
Задание 54
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
H2 |
N+2 |
SO |
|
Пользуясь методом МО:
а) постройте энергетическую диаграмму молекулярных орбиталей частицы*;
б) распределите валентные электроны по энергетическим уровням частицы на диаграмме;
в) напишите реакцию образования частицы из ее составляющих;
г) определите порядок связи в частице;
д) установите, пара- или диамагнитна ли частица.
Скачать решение задания 54 (методичка 140в) 50р
Задание 55
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
Na2 |
H+2 |
CF |
|
Пользуясь методом МО:
а) постройте энергетическую диаграмму молекулярных орбиталей частицы*;
б) распределите валентные электроны по энергетическим уровням частицы на диаграмме;
в) напишите реакцию образования частицы из ее составляющих;
г) определите порядок связи в частице;
д) установите, пара- или диамагнитна ли частица.
Скачать решение задания 55 (методичка 140в) 50р
Задание 56
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
S2 |
O2-2 |
SiO |
|
Пользуясь методом МО:
а) постройте энергетическую диаграмму молекулярных орбиталей частицы*;
б) распределите валентные электроны по энергетическим уровням частицы на диаграмме;
в) напишите реакцию образования частицы из ее составляющих;
г) определите порядок связи в частице;
д) установите, пара- или диамагнитна ли частица.
Скачать решение задания 56 (методичка 140в) 50р
Задание 57
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
Si2 |
C+2 |
BF |
|
Пользуясь методом МО:
а) постройте энергетическую диаграмму молекулярных орбиталей частицы*;
б) распределите валентные электроны по энергетическим уровням частицы на диаграмме;
в) напишите реакцию образования частицы из ее составляющих;
г) определите порядок связи в частице;
д) установите, пара- или диамагнитна ли частица.
Скачать решение задания 57 (методичка 140в) 50р
Задание 58
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
O2 |
B-2 |
BO |
|
Пользуясь методом МО:
а) постройте энергетическую диаграмму молекулярных орбиталей частицы*;
б) распределите валентные электроны по энергетическим уровням частицы на диаграмме;
в) напишите реакцию образования частицы из ее составляющих;
г) определите порядок связи в частице;
д) установите, пара- или диамагнитна ли частица.
Скачать решение задания 58 (методичка 140в) 50р
Задание 59
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
Ne2 |
O-2 |
BN |
|
Пользуясь методом МО:
а) постройте энергетическую диаграмму молекулярных орбиталей частицы*;
б) распределите валентные электроны по энергетическим уровням частицы на диаграмме;
в) напишите реакцию образования частицы из ее составляющих;
г) определите порядок связи в частице;
д) установите, пара- или диамагнитна ли частица.
Скачать решение задания 59 (методичка 140в) 50р
Задание 60
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
Br2 |
O2-2 |
ClF |
|
Пользуясь методом МО:
а) постройте энергетическую диаграмму молекулярных орбиталей частицы*;
б) распределите валентные электроны по энергетическим уровням частицы на диаграмме;
в) напишите реакцию образования частицы из ее составляющих;
г) определите порядок связи в частице;
д) установите, пара- или диамагнитна ли частица.
Скачать решение задания 60 (методичка 140в) 50р
Задание 61
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
XeF2 |
SnCL4 |
SO2Cl2 |
|
Пользуясь методом ВС:
а) определите пространственную конфигурацию молекулы;
б) установите, обладает ли это молекула электрическим моментом диполя.
Скачать решение задания 61 (методичка 140в) 50р
Задание 62
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
BeF2 |
AsH3 |
SClF3 |
|
Пользуясь методом ВС:
а) определите пространственную конфигурацию молекулы;
б) установите, обладает ли это молекула электрическим моментом диполя.
Скачать решение задания 62 (методичка 140в) 50р
Задание 63
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
SnCl2 |
BBr3 |
CO2 |
|
Пользуясь методом ВС:
а) определите пространственную конфигурацию молекулы;
б) установите, обладает ли это молекула электрическим моментом диполя.
Скачать решение задания 63 (методичка 140в) 50р
Задание 64
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
HgCl2 |
ClF5 |
Cl2O |
|
Пользуясь методом ВС:
а) определите пространственную конфигурацию молекулы;
б) установите, обладает ли это молекула электрическим моментом диполя.
Скачать решение задания 64 (методичка 140в) 50р
Задание 65
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
BeCl2 |
PBr3 |
SO2 |
|
Пользуясь методом ВС:
а) определите пространственную конфигурацию молекулы;
б) установите, обладает ли это молекула электрическим моментом диполя.
Скачать решение задания 65 (методичка 140в) 50р
Задание 66
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
CF4 |
SbCl3 |
POF3 |
|
Пользуясь методом ВС:
а) определите пространственную конфигурацию молекулы;
б) установите, обладает ли это молекула электрическим моментом диполя.
Скачать решение задания 66 (методичка 140в) 50р
Задание 67
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
ICl3 |
AsBr3 |
HeO3 |
|
Пользуясь методом ВС:
а) определите пространственную конфигурацию молекулы;
б) установите, обладает ли это молекула электрическим моментом диполя.
Скачать решение задания 67 (методичка 140в) 50р
Задание 68
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
BeBr2 |
H2O |
OF2 |
|
Пользуясь методом ВС:
а) определите пространственную конфигурацию молекулы;
б) установите, обладает ли это молекула электрическим моментом диполя.
Скачать решение задания 68 (методичка 140в) 50р
Задание 69
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
BF3 |
SF4 |
SOCl2 |
|
Пользуясь методом ВС:
а) определите пространственную конфигурацию молекулы;
б) установите, обладает ли это молекула электрическим моментом диполя
Скачать решение задания 69 (методичка 140в) 50р
Задание 70
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
SF6 |
BrF3 |
CS2 |
|
Пользуясь методом ВС:
а) определите пространственную конфигурацию молекулы;
б) установите, обладает ли это молекула электрическим моментом диполя.
Скачать решение задания 70 (методичка 140в) 50р
Решение задач 71-105 (методичка 140)
Задание 71
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
BCl3 |
PCl5 |
POCl3 |
|
Пользуясь методом ВС:
а) определите пространственную конфигурацию молекулы;
б) установите, обладает ли это молекула электрическим моментом диполя.
Скачать решение задания 71 (методичка 140в) 50р
Задание 72
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
GeH4 |
NF3 |
NOF3 |
|
Пользуясь методом ВС:
а) определите пространственную конфигурацию молекулы;
б) установите, обладает ли это молекула электрическим моментом диполя.
Скачать решение задания 72 (методичка 140в) 50р
Задание 73
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
CCl4 |
H2Te |
SO2F2 |
|
Пользуясь методом ВС:
а) определите пространственную конфигурацию молекулы;
б) установите, обладает ли это молекула электрическим моментом диполя.
Скачать решение задания 73 (методичка 140в) 50р
Задание 74
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
GeF4 |
H2Se |
SO3 |
|
Пользуясь методом ВС:
а) определите пространственную конфигурацию молекулы;
б) установите, обладает ли это молекула электрическим моментом диполя.
Скачать решение задания 74 (методичка 140в) 50р
Задание 75
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
CuF2 |
BrF5 |
CCl2O |
|
Пользуясь методом ВС:
а) определите пространственную конфигурацию молекулы;
б) установите, обладает ли это молекула электрическим моментом диполя.
Скачать решение задания 75 (методичка 140в) 50р
Задание 76
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
MgCl2 |
SiCl4 |
GeO2 |
|
Пользуясь методом ВС:
а) определите пространственную конфигурацию молекулы;
б) установите
Скачать решение задания 76 (методичка 140в) 50р
Задание 77
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
CdCl3 |
ClF3 |
TeO2 |
|
Пользуясь методом ВС:
а) определите пространственную конфигурацию молекулы;
б) установите, обладает ли это молекула электрическим моментом диполя.
Скачать решение задания 77 (методичка 140в) 50р
Задание 78
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
PH3 |
XeF4 |
SnF2 |
|
Пользуясь методом ВС:
а) определите пространственную конфигурацию частицы*;
б) установите, обладает ли эта молекула электрическим моментом диполя.
Скачать решение задания 78 (методичка 140в) 50р
Задание 79
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
PF3 |
BeI2 |
SCl2O2 |
|
Пользуясь методом ВС:
а) определите пространственную конфигурацию молекулы;
б) установите, обладает ли это молекула электрическим моментом диполя.
Скачать решение задания 79 (методичка 140в) 50р
Задание 80
|
Молекулы и молекулярные ионы |
|||
|
а |
б |
в |
|
|
CaF2 |
AsCl3 |
SClF5 |
|
Пользуясь методом ВС:
а) определите пространственную конфигурацию молекулы;
б) установите, обладает ли это молекула электрическим моментом диполя.
Скачать решение задания 80 (методичка 140в) 50р
Задание 81
Какая из реакций горения аммиака термодинамически более вероятна?
a) 4 NH3 (г) +5O2 (г) = 4NO (г) +6H2O (г)
б) 4 NH3 (г) +3O2 (г) = 2N2 (г) +6H2O (г)
Как достигают получения желаемого продукта окисления аммиака в производстве
азотной кислоты?
Скачать решение задания 81 (методичка 140в) 50р
Задание 82
Один из способов получения кислорода в лаборатории основан на термическом
разложении оксохлората (V) калия (бертолстовой соли):
2 KClO3 (к) = 2KCl (к) + 3O2 (г)
Объясните, почему этот процесс необратим. При ответе используйте значения ΔH0, ΔS0, ΔG0
Скачать решение задания 82 (методичка 140в) 50р
Задание 83
Исходя из значений стандартной молярной энтальпии образования, вычислите энтальпии сгорания: а) угля (графита), б) метана, в) этанола. Какое из этих горючих веществ энергетически наиболее выгодно использовать в качестве топлива?
Скачать решение задания 83 (методичка 140в) 50р
Задание 84
Вычислите стандартные значения ΔG0 для реакций:
а) BaCO3 (к) = BaO (к) +CO2 (г)
б) CaCO3 (к) = CaO (к) +CO2 (г)
и определите, какой из приведённых карбонатов обладает большей термической устойчивостью.
Скачать решение задания 84 (методичка 140в) 50р
Задание 85
Один из способов промышленного получения водорода основан на взаимодействие при высокой температуре метана с водяным паром:
CH4 (г) + H2O (г) = CO (г) + 3H3 (г)
Обоснуйте принципиальную возможность протекания этой реакции
Скачать решение задания 85 (методичка 140в) 50р
Задание 86
Каков характер изменения энтропии (ΔS>0, ΔS <0 или ΔS=0) при протекании следующих реакций и чем это объясняется
S (к) + O2 (г) = SO2 (г)
4Fe (к) + 3O2 (г) = 2Fe2O3 (к)
2(NH4)2CrO4 (к) = Cr2O3 (к) + 2NH3 (г)+ N2 (г) + 5H2O (г)
Скачать решение задания 86 (методичка 140в) 50р
Задание 87
Обоснуйте возможность получения кислорода в лаборатории термическим разложением нитрата калия при:
а) 120°С,
б) 1200°С,
KNO3 (к) = KNO2 (к) + 1/2O2 (г)
При ответе используйте значения ΔH0298, ΔS0, ΔG0 процесса
Скачать решение задания 87 (методичка 140в) 50р
Задание 88
Используя закон Гесса, определите теплоту (энтальпию) образования CaCO2, если известны тепловые эффекты следующих реакций
Ca (к) + 0,5O2 (г) = CaO (к) ΔH0298 = - 635,5 кДж
C (графит) + O2 (г) = CO2 (г) ΔH0298 = - 393,5 кДж
CaO (к) + СO2 (г) = CaСO3 (к) ΔH0298 = - 178,1 кДж
Скачать решение задания 88 (методичка 140в) 50р
Задание 89
Каков характер изменения энтропии (ΔS>0, ΔS <0 или ΔS=0) при протекании следующих реакций и чем это объясняется?
а) С(графит) + О2(г) = СО2(г);
б) С(графит) + 1/2 О2(г) = СО(г);
в) СО(г) + 1/2 О2(г) = СО2(г).
Скачать решение задания 89 (методичка 140в) 50р
Задание 90
Предскажите и проверьте расчетами знак изменения энтропии в следующих реакциях:
а) ЗН2(г) + N2(г) = 2NH3(г);
б) 2КClO3(к) = 2КСl(к) + 3O2(г);
в) СuО(к) + H2(г) = Сu(к) + H2O(г).
Скачать решение задания 90 (методичка 140в) 50р
Задание 91
Вычислите значения ΔG0298 реакций
FeO(к) + 1/2 С(графит) = Fe(к) + 1/2 СО2(г);
FeO(к) + СО(г) = Fe(к) + СО2(г).
Которая из этих реакций наиболее вероятна?
Скачать решение задания 91 (методичка 140в) 50р
Задание 92
Вычислите тепловой эффект реакции:
KOH (p) + HCl (p)
CsOH (p) + H2SO4 (p)
NaOH (p)+HNO3 (p)
для растворов в расчете на 1 моль H2O в стандартных условиях. Почему тепловые эффекты этих реакций одинаковы?
Скачать решение задания 92 (методичка 140в) 50р
Задание 93
Рассчитайте изменение энтальпии, энтропии и энергии Гиббса для реакции окисления NO в NO-2 в стандартных условиях. Возможна ли эта реакция при 25 °С?
Скачать решение задания 93 (методичка 140в) 50р
Задание 94
Пользуясь значениями ΔG0обр соединений, вычислите ΔG0298 реакций:
COCl2 (г) = CO (г) + Cl (г)
SO2 (г) + NO2 (г) = SO3 (г) + NO (г)
И определите возможность их осуществления в стандартных условиях.
Скачать решение задания 94 (методичка 140в) 50р
Задание 95
Рассчитайте тепловой эффект реакции горения N2H4, B2H4, CH4
N2H4 (ж) + O2 (г) = N2 (г) + 2H2O (ж)
B2H4 (г) +3O2 (г) = B2O3 (к) + 3H2O (ж)
CH4 (г) + 2O2 (г) = CO2 (г) + 2H2O (ж)
Какое из этих веществ энергетически наиболее выгодно использовать в качестве топлива?
Скачать решение задания 95 (методичка 140в) 50р
Задание 96
Вычислите стандартные значения ΔG0298 для реакций:
а) NaNO3(к) = NaNO2(к) + 1/2О2(г);
б) Pb(NO3) (к) = РbО(к) + 2NO2(г)+1/2O2(г)
и определите, какой из нитратов обладает большей термической устойчивостью.
Скачать решение задания 96 (методичка 140в) 50р
Задание 97
Вычислите ΔG0298 для реакций:
1) 2Аl3+(р) + 3S2(р) = Аl2S3(к);
2) 2Аl3+(р) + 6H2O(ж) + 3S2(р) = 2А1(ОН)3(к) + 3H2S(p).
Какой из этих процессов термодинамически более вероятен? Возможно ли образование осадка Al2S3 в водном растворе?
Скачать решение задания 97 (методичка 140в) 50р
Задание 98
Вычислите значения ΔH0298, ΔS0298 и ΔG0298 для реакции:
NH4Cl (к) = NH3(г) + HCl(г).
Как влияет температура на направление процесса?
Скачать решение задания 98 (методичка 140в) 50р
Задание 99
Вычислите значения ΔG0298 для реакций:
1) 2КСlO3(к) = 2КС1 (к) + 3O2 (г),
2) Na2SO4 (к) = Na2SO3 (к) + 1/2O2 (г).
Какое из этих соединений менее устойчиво к нагреванию и может использоваться для получения кислорода?
Скачать решение задания 99 (методичка 140в) 50р
Задание 100
Вычислите значения ΔH0298, ΔS0298, ΔG0298 и ΔG0573 для реакций:
1) NH4NO3(к) = H3N(г)+ HNО3(г),
2) NH4NO3(к) = N2O(г) + 2H2O(ж).
Как влияет температура на вероятность протекания этих процессов? Какой из этих процессов и почему практически необратим?
Скачать решение задания 100 (методичка 140в) 50р
Задание 101
Составьте выражение константы равновесия для следующих реакций:
С (тв) + 2Н2 (г) - СН4 (г)
С (тв) + CO2 (г) - 2CO (г)
С (тв) + H2O (г) - CO (г) + H2 (г)
2СO (г) + O2 (г) - 2CO2 (г)
N2 (г) + O2 (г) - 2NO (г)
Скачать решение задания 101 (методичка 140в) 50р
Задание 102
Сформулируйте определение понятия «химическое равновесие». Приведите выражение константы равновесия следующих реакций:
N2 (г) + 3H2 (г) - 2NH3 (г)
2NO (г) + O2 (г) - 2NO2 (г)
SO2 (г) + 2H2S (г) - 3S (тв) + 2H2O (г)
2H2S (г) + 3O2 (г) - 2SO2 (г) + 2H2O (г)
NH4Cl (тв) - NH3 (г) + HCl (г)
Скачать решение задания 102 (методичка 140в) 50р
Задание 103
Составьте выражение константы равновесия и вычислите ее значение для реакции:
2HCl (г) - Н2 (г) + I2 (г)
если равновесные константы равны:
Н2 = 18,14 моль/л
I2 = 0,41 моль/л
HI = 19,38 моль/л
Ответ: 0,01980
Скачать решение задания 103 (методичка 140в) 50р
Задание 104
Составьте выражение константы равновесия и вычислите ее значение для реакции:
N2O4 (г) - 2NO2 (г)
если равновесные константы равны:
N2O4 = 0,00140 моль/л
NO2 = 0,0172 моль/л
Ответ: 0,211 моль/л
Скачать решение задания 104 (методичка 140в) 50р
Задание 105
Сформулируйте принцип подвижного равновесия (принцип Ле Шателье). Используя принцип Ле Шателье, укажите стрелкой направление (прямое или обратное) смещения химического равновесия в следующих системах:
а) при повышении температуры
NO2 (г) + SO2 (г) - NO (г) + SO3 (г) ΔH < 0
NH4Cl (тв) - NH3 (г) + HCl (г) ΔH >0
SO2 (г) + 2H2S (г) - 3S (тв) + 2H2O (г) ΔH < 0
2H2S (г) + 3O2 (г) - 2SO2 (г) + 2H2O (г) ΔH < 0
б) при понижении давления
NO2 (г) + SO2 (г) - NO (г) + SO3 (г)
NH4Cl (тв) - NH3 (г) + HCl (г)
SO2 (г) + 2H2S (г) - 3S (тв) + 2H2O (г)
2H2S (г) + 3O2 (г) - 2SO2 (г) + 2H2O (г)
Скачать решение задания 105 (методичка 140в) 50р
Решение задач 106-140 (методичка 140)
Задание 106
Составьте выражение константы равновесия и вычислите ее значение для реакции
PCl5 (г) - PCl3 (г) + Cl2 (г),
если равновесные концентрации имеют следующие значения: [РСl5] =0,015 моль/л, [РСl3] = 0,025 моль/л, [Сl2] = 0,025 моль/л.
Скачать решение задания 106 (методичка 140в) 50р
Задание 107
Вычислите начальную и равновесную концентрацию азота в системе
N2 (г) + 3Н2 (г) - 2NH3 (г)
если равновесные константы равны:
Н2 = 0,3 моль/л
NH3 = 0,09 моль/л
константа равновесия реакции при 673К составляет 0,1
Скачать решение задания 107 (методичка 140в) 50р
Задание 108
Вычислите константу равновесия и равновесные концентрации CO, H2O, H2
CO (г) + Н2O (г) - CO2 (г) + H2 (г)
если равновесная концентрация: CO2 = 0,1 моль/л, а исходные концентрации оксида углерода и паров воды, соответственно, равны 0,16 моль/л
Скачать решение задания 108 (методичка 140в) 50р
Задание 109
Вычислите равновесную концентрацию йода в системе:
2Hl (г) - H2 (г) + I2 (г)
если исходная концентрация йодида водорода равна 0,55 моль/л, а константа равновесия К = 0,11
Скачать решение задания 109 (методичка 140в) 50р
Задание 110
Укажите стрелкой в каком направлении сместиться химическое равновесие системы
4HCl (г) + O2 (г) - 2H2O (г) + 2Cl2 (г), ΔH < 0
при увеличении температуры. При каких условиях (повышение или понижение температуры) кислород является более сильным окислителем, чем хлор?
Скачать решение задания 110 (методичка 140в) 50р
Задание 111
Укажите стрелкой, в каком направлении сместится химическое равновесие следующих систем:
а) при повышении температуры
SO2 (г) + 1/2 O2 (г) - SO3 (г), ΔH < 0
CO (г) + H2O (г) - CO2 (г) +H2 (г), ΔH < 0
б) при понижении давления
SO2 (г) + 1/2 O2 (г) - SO3 (г)
CO (г) + H2O (г) - CO2 (г) +H2 (г)
Напишите выражение константы равновесия для приведенных реакций
Скачать решение задания 111 (методичка 140в) 50р
Задание 112
В смеси NO2 (бурого цвета) и N2O4 (бесцветен) протекает обратимая реакция: 2NO2 (г) - N2O4 (г), ΔH < 0. В каком направлении (прямом или обратном) сместится химическое равновесие при: а) увеличении температуры; б) уменьшении температуры; в) увеличении давления? Как это скажется на изменении окраски смеси?
Скачать решение задания 112 (методичка 140в) 50р
Задание 113
Напишите выражение константы химического равновесия реакции:
FeCl3 (р) + 3KCNS (р) - Fe (CNS)3 (р) + 3KCl (р)
В каком направлении сместиться химическое равновесие при добавлении к системе, а) хлорида железа III, б) роданида калия, в) хлорида калия и как это отразиться на окраске раствора?
Скачать решение задания 113 (методичка 140в) 50р
Задание 114
Вычислите начальную концентрацию N2O4 и константу равновесия реакции: N2O4 (г) - 2NO (г), если равновесные концентрации равны:
NO = 0,05 моль/л
N2O4 = 0,05 моль/л
Ответ: Cнач (N2O4) = 0,075 моль/л, Kc = 0, 05 моль/л
Скачать решение задания 114 (методичка 140в) 50р
Задание 115
Оксид азота (III) при температуре ниже 0°С диссоциирует согласно уравнению:
N2O3 (г) - NO (г) + NO2 (г). Вычислите начальную концентрацию N2O3 и константу равновесия, если равновесные концентрации раны: NO2 = 0,3 моль/л,
N2O3 = 0,03 моль/л
Скачать решение задания 115 (методичка 140в) 50р
Задание 116
Используя принцип Ле Шателье, укажите стрелкой направление (прямое или обратное) смещение химического равновесия следующих систем:
а) при понижении температуры
4NH3 (г) + 5O2 (г) - 4NO (г) + 6H2O (г) ΔH < 0
N2O3 (г) - NO (г) + NO2 (г) ΔH >0
CO (г) + H2O (г) - CO2 (г) + H2 (г) ΔH < 0
б) при повышении давления
4NH3 (г) + 5O2 (г) - 4NO (г) + 6H2O (г)
N2O3 (г) - NO (г) + NO2 (г)
CO (г) + H2O (г) - CO2 (г) + H2 (г)
Составьте выражение константы равновесия для приведенных систем
Скачать решение задания 116 (методичка 140в) 50р
Задание 117
Используя принцип Ле Шателье, укажите стрелкой направление (прямое или обратное) смещение химического равновесия следующих систем:
а) при повышении температуры
3Fe2O3 (тв) + Н2 (г) - 2Fe3O4 (тв) + H2O (г) ΔH < 0
N2 (г) + O2 (г) - 2NO (г) ΔH >0
H2 (г) + Cl2 (г) - 2HCl (г) ΔH < 0
б) при изменении давления
3Fe2O3 (тв) + Н2 (г) - 2Fe3O4 (тв) + H2O (г) ΔV = 0
N2 (г) + O2 (г) - 2NO (г) ΔV = 0
H2 (г) + Cl2 (г) - 2HCl (г) ΔV = 0
Составьте выражение константы равновесия для приведенных систем
Скачать решение задания 117 (методичка 140в) 50р
Задание 118
Используя принцип Ле Шателье, укажите стрелкой направление (прямое или обратное) смещение химического равновесия следующих систем:
а) при понижении температуры
CO (г) + Cl2 (г) - COCl2 (г) ΔH < 0
2CO2 (г) - 2CO (г) + O2(г) ΔH > 0
2CO (г) + O2 (г) - 2CO2 (г) ΔH < 0
б) при повышении давления
CO (г) + Cl2 (г) - COCl2 (г) ΔH < 0
2CO2 (г) - 2CO (г) + O2 (г) ΔH > 0
2CO (г) + O2 (г) - 2CO2 (г) ΔH < 0
Составьте выражение константы равновесия для приведенных систем
Скачать решение задания 118 (методичка 140в) 50р
Задание 119
Используя принцип Ле Шателье, укажите стрелкой направление (прямое или обратное) смещение химического равновесия следующих систем:
а) при повышении температуры
2N2O (г) - 2N2 (г) + O2 (г) ΔH <0
(NH4)3PO4 (тв) - 3NH2 (г) + Н3PO4 (ж) ΔH >0
CH4 (г) - C (тв) + 2H2 (г) ΔH > 0
б) при изменении давления
2N2O (г) - 2N2 (г) + O2 (г) ΔH <0
(NH4)3PO4 (тв) - 3NH2 (г) + Н3PO4 (ж) ΔH >0
CH4 (г) - C (тв) + 2H2 (г) ΔH > 0
Составьте выражение константы равновесия для приведенных систем
Скачать решение задания 119 (методичка 140в) 50р
Задание 120
Вычислите равновесные концентрации CO и O2 в системе: 2CO2 (г) - 2CO (г) + O2 (г), если начальная концентрация CO2 составляет 2моль/л, при установлении равновесия концентрации CO2 равна 0,2 моль/л.
Скачать решение задания 120 (методичка 140в) 50р
Задание 121
К 100 мл раствора серной кислоты с массовой долей H2SO4 95,72% (плотность 1,835 г/мл) прилили 400 мл воды. Получили раствор с плотностью 1,22 г/мл. Рассчитайте массовую долю H2SO4 в полученном растворе и молярную концентрацию раствора.
Скачать решение задания 121 (методичка 140в) 50р
Задание 122
Рассчитайте, сколько мл воды необходимо прилить к 100 мл раствора азотной кислоты с массовой долей HNO3 30% (плотность 1,18 г/мл) для получения раствора с массовой долей вещества 20%
Скачать решение задания 122 (методичка 140в) 50р
Задание 123
К 500 мл раствора азотной кислоты с массовой долей HNO3 30% (плотность 1,18 г/мл) прилили 1 л воды. рассчитайте массовую долю HNO3 в полученном растворе.
Скачать решение задания 123 (методичка 140в) 50р
Задание 124
Смешали 100 мл раствора гидроксида калия с массовой долей КОН 12, 08 % (плотность 1,11 г/мл) и 200 мл раствора с массовой долей KOH 40,37% (плотность 1,40 г/мл). Смесь разбавили водой до двух литров. Рассчитайте молярность полученного раствора.
Скачать решение задания 124 (методичка 140в) 50р
Задание 125
Рассчитайте объем раствора серной кислоты с массовой долей H2SO4 95,72% (плотность 1,835 г/мл), необходимый для приготовления двух литров раствора кислоты молярной концентрации 0,2 моль/л.
Скачать решение задания 125 (методичка 140в) 50р
Задание 126
Вычислите молярную концентрацию и титр раствора карбоната натрия с массовой долей Na2CO3 8,8% (плотность 1,09 г/мл). Принять объем раствора Na2CO3 равным 1л.
Скачать решение задания 126 (методичка 140в) 50р
Задание 127
Рассчитайте молярную концентрацию раствора азотной кислоты с массовой долей HNO3 19,19% (плотность 1,11 г/мл) и массу HNO3, содержащуюся в 2-х литрах этого раствора.
Скачать решение задания 127 (методичка 140в) 50р
Задание 128
Вычислите массу HNO3, содержащуюся в растворе азотной кислоты, для нейтрализации которой потребовалось 50 мл полумолярного 0,5 М раствора гидроксида натрия. Чему равен титр раствора NaOH?
Скачать решение задания 128 (методичка 140в) 50р
Задание 129
Рассчитайте, сколько литров 0,5 М раствора серной кислоты можно приготовить из 50 мл раствора кислоты с массовой долей H2SO4 80,25% (плотность 1, 73 г/мл).
Скачать решение задания 129 (методичка 140в) 50р
Задание 130
Вычислите массовую долю карботана калия в растворе и молярную концентрацию раствора, содержащего 75 г K2CO3 в 300 мл воды плотность – 1,0 г/мл
Скачать решение задания 130 (методичка 140в) 50р
Задание 131
К 2-м литрам раствора азотной кислоты с массовой долей HNO3 10,97% (плотность 1,06 г/мл) прилили 2 л раствора той же кислоты с массовой долей HNO3 2,16% (плотность 1,01 г/мл). Вычислите массовую долю HNO3 в полученном растворе и молярную концентрацию раствора, допуская что объем его равен 4л.
Скачать решение задания 131 (методичка 140в) 50р
Задание 132
Определите, какой объем воды необходимо прилит к 1 раствора серной кислоты с массовой долей H2SO4 35,01% (плотность 1,26 г/мл) для получения раствора с массовой долей H2SO4 12%
Скачать решение задания 132 (методичка 140в) 50р
Задание 133
Вычислите объем раствора карбоната натрия с массовой долей Na2CO3 9,75% (плотность 1,10 г/мл) необходимый для приготовления 300 г раствора с массовой долей Na2CO3 3%.
Скачать решение задания 133 (методичка 140в) 50р
Задание 134
К 1 л раствора гидроксида калия с массовой долей KO 9,96% (плотность 1,09 г/мл) прилили 0,5 л раствора той же щелочи с массовой долей KOH 5,66% (плотность 1,05г/мл). Смесь разбавили водой до 3-х литров. Рассчитайте молярную концентрацию полученного раствора.
Скачать решение задания 134 (методичка 140в) 50р
Задание 135
Рассчитайте объем раствора хлороводородной кислоты массовой долей HСl 20, 39 % (плотность 1,10 г/мл), необходимый для приготовления 1 л раствора кислоты с массовой долей HСl 10, 17 % (плотность 1,05 г/мл).
Скачать решение задания 135 (методичка 140в) 50р
Задание 136
Рассчитайте молярность и титр раствора гидроксида натрия с массовой долей NaOH 18,25% (плотность 1,20 г/мл)
Скачать решение задания 136 (методичка 140в) 50р
Задание 137
Рассчитайте объем раствора хлороводородной кислоты с массовой долей HCl 38,32% (плотность 1,19 г/мл), необходимый для приготовления 3л 0,1М раствора.
Скачать решение задания 137 (методичка 140в) 50р
Задание 138
Смешали 100 мл азотной кислоты с массовой долей HNO3 39,02% (плотность 1,24 г/мл) и 400 мл раствора азотной кислоты с массовой долей HNO3 15,95% (плотность 1,09 г/мл). Рассчитайте массовую долю HNO3 в полученном растворе. Какова молярная концентрация этого раствора, если принять его объем равным 500 мл?
Скачать решение задания 138 (методичка 140в) 50р
Задание 139
К 50 мл раствора серной кислоты с массовой долей H2SO4 4,75% (плотность 1,03 г/мл) прилили 50 мл одномолярного раствора гидроксида калия. Какова реакция среды полученного раствора на индикатор (кислая, нейтральная или щелочная)?
Скачать решение задания 139 (методичка 140в) 50р
Задание 140
На нейтрализацию гидроксида натрия, находящегося в растворе объемом 100 мл, израсходовано 50 мл децимолярного (0,1М) раствора серной кислоты. Рассчитайте массу NaOH в исходном растворе, титр раствора и его молярность
Скачать решение задания 140 (методичка 140в) 50р
