Решение задач 1-35 (методичка 140)
Задание 1
Перечислите положения квантовой (волновой) механики, на которых основана теория строения электронной оболочки атома.
Прокомментируйте фразу: «Квантовый характер излучения и поглощения энергии системой микрочастиц».
Приведите электронную конфигурацию атома марганца и иона марганца (II) в основном состоянии.
Назовите число орбиталей атома марганца, имеющих в основном состоянии атома по одному электрону.
Охарактеризуйте набором квантовых чисел каждую из 3d-орбиталей.
Какое число электронов атома может находиться в 3d-состоянии?
Скачать решение задания 1 (методичка 140в) 50р
Задание 2
Перечислите положения квантовой (волновой) механики, на которых основана теория строения атома.
Прокомментируйте фразу: «Волновой характер движения микрочастиц»
Приведите электронную конфигурацию атома германия.
Составьте энергетическую схему распределения по орбиталям электронов атома германия.
Охарактеризуйте набором квантовых чисел 4 s – орбиталь.
Какое максимальное число электронов может находиться в энергетическом 5 s – состоянии?
Скачать решение задания 2 (методичка 140в) 50р
Задание 3
Перечислите представления квантовой механики, на которых основана теория строения атома.
Приведите электронную конфигурацию атома технеция в основном состоянии.
Назовите число орбиталей атома технеция, имеющих в основном со-стоянии атома по одному электрону.
Охарактеризуйте набором квантовых чисел каждую из 4d-орбиталей.
Какое максимальное число электронов может находиться в 4d-состоянии?
Скачать решение задания 3 (методичка 140в) 50р
Задание 4
На основе представлений квантовой механики сформулируйте понятие «электронное облако»
Приведите электронную конфигурацию атома индия и иона индия (III). Составьте энергетическую схему распределения по орбиталям электронов атома индия.
Какое максимальное число электронов может находиться в 5 p–состоянии?
Скачать решение задания 4 (методичка 140в) 50р
Задание 5
Как Вы представляете модель движения электрона в атоме?
Нарисуйте расположение одной s- и трех р-орбиталей относительно осей координат.
Опишите форму орбитали, характеризующейся квантовыми числами: n = 6; l = 0; ml = 0.
Приведите электронную конфигурацию атома цезия и иона цезия (I) в основном состоянии.
Составьте энергетическую схему распределения по орбиталям электронов атома цезия.
Охарактеризуйте набором квантовых чисел каждую из 5p-орбиталей.
Какое число электронов может находиться в энергетическом 6s-состоянии?
Скачать решение задания 5 (методичка 140в) 50р
Задание 6
На основе представлений квантовой механики сформулируйте понятие «орбиталь».
Какую форму имеет s-орбиталь; р-орбиталь? Нарисуйте их модели.
Приведите электронную конфигурацию атома брома и бромид-иона.
Составьте энергетическую схему распределения по орбиталям электронов атома брома.
Охарактеризуйте набором квантовых чисел каждую из 4р-орбиталей.
Какое максимальное число электронов может находиться в энергетическом 4р-состоянии?
Скачать решение задания 6 (методичка 140в) 50р
Задание 7
Сформулируйте понятие «орбиталь». Нарисуйте модели d-орбиталей. Приведите их буквенные обозначения.
Составьте электронную конфигурацию атома ванадия.
Назовите число 3d-орбиталей атома ванадия, не заполняемых электронами атома в основном состоянии.
Назовите суммарное спиновое число электронов 3d-состояния атома ванадия.
Охарактеризуйте набором квантовых чисел 4s-орбиталь.
Скачать решение задания 7 (методичка 140в) 50р
Задание 8
Известно, что состояние электрона в атоме можно описать с помощью набора квантовых чисел. Назовите и обозначьте квантовые числа, обоснуйте применение каждого из них.
Приведите электронную конфигурацию атома рутения в основном состоянии.
Назовите число орбиталей атома рутения, имеющих в основном состоянии по одному электрону.
Охарактеризуйте набором квантовых чисел 3s-орбиталь.
Скачать решение задания 8 (методичка 140в) 50р
Задание 9
Приведите обозначение главного квантового числа, обоснуйте его применение.
Укажите схему, отражающую верное распределение электронов по s- и р-орбиталям внешнего слоя атома таллия:
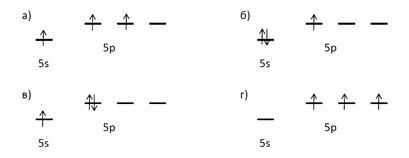
Дайте пояснения к ответу.
Составьте электронную конфигурацию иона таллия (I).
Какое максимальное число электронов может находиться в энергетическом 6р-состоянии?
Охарактеризуйте набором квантовых чисел каждую из 6р-орбиталей.
Скачать решение задания 9 (методичка 140в) 50р
Задание 10
Сформулируйте понятия: «энергетический уровень» (квантовый слой), «энергетический подуровень» (подслой).
Приведите электронную конфигурацию атома гафния в основном состоянии.
Составьте энергетическую схему распределения по орбиталям электронов атома гафния.
Какое максимальное число электронов может находиться в энергетическом 5d- состоянии?
Охарактеризуйте набором квантовых чисел 1s-орбиталь.
Скачать решение задания 10 (методичка 140в) 50р
Задание 11
Приведите обозначение орбитального квантового числа, охарактеризуйте его применение.
Какие значения принимает орбитальное квантовое число для данного главного квантового числа: а) n = 1, б) n = 2?
Атом какого элемента имеет электронную конфигурацию: 1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p4?
Дайте пояснения.
Назовите число орбиталей данного атома, имеющих в основном состоянии по одному электрону.
Скачать решение задания 11 (методичка 140в) 50р
Задание 12
Какие значения принимает орбитальное квантовое число для данного главного квантового числа: а) n = 3, б) n = 4?
Составьте энергетическую схему распределения по орбиталям электронов атома кобальта.
Обоснуйте, какая из электронных конфигураций соответствует иону кобальта (II): a) 1s22s22p63s23p63d54s2, б) 1s22s22p63s23p63d74s2, в) 1s22s22p63s23p63d74s0.
Назовите суммарное спиновое число 3d-электронов атома кобальта.
Какое квантовое число определяет число орбиталей d-подуровня?
Скачать решение задания 12 (методичка 140в) 50р
Задание 13
Приведите обозначение магнитного квантового числа, обоснуйте его применение.
Укажите число орбиталей, описываемых орбитальным квантовым числом: а) l = 0, б) l = 1.
Приведите электронную конфигурацию: а) атома йода, б) йодид-иона в основном состоянии.
Составьте энергетическую схему распределения по орбиталям электронов атома йода.
Охарактеризуйте набором квантовых чисел каждую из 5d-орбиталей.
Какое максимальное число электронов может находиться в энергетическом 5d-состоянии?
Скачать решение задания 13 (методичка 140в) 50р
Задание 14
Расскажите об использовании магнитного квантового числа для описания состояния электрона в атоме.
Опишите форму орбитали, характеризующейся квантовыми числами: n=3, l = 1, ml= 0, ±1.
Нарисуйте расположение трех р-орбиталей вдоль осей координат.
Приведите электронную конфигурацию: а) атома теллура, б) теллурид-иона в основном состоянии.
Какая из нижеприведенных схем отражает верное распределение электронов атома теллура по s-и р-орбиталям внешнего слоя?

Дайте пояснения к ответу.
Какое максимальное число электронов может находиться в энергетическом 6d-состоянии?
Скачать решение задания 14 (методичка 140в) 50р
Задание 15
Укажите число орбиталей, характеризующихся орбитальным квантовым числом:
а) l=2
б) l=3
Приведите электронную конфигурацию атома осмия;
Составьте энергетическую схему распределения по орбиталям электронов атома осмия;
Назовите число орбиталей атома осмия, имеющих в основном состоянии атома по одному электрону;
Охарактеризуйте набором квантовых чисел каждую из 4f-орбиталей;
Какое максимальное число электронов может находиться в энергетическом 4f-состоянии?
Скачать решение задания 15 (методичка 140в) 50р
Задание 16
Приведите обозначение спинового квантового числа; обоснуйте его применение.
Атом какого элемента имеет электронную конфигурацию: 1s22s22p63s23p63dl04s24p64d104f145s25p65d106s26p2? Дайте пояснения к ответу.
Составьте энергетическую схему распределения по орбиталям внешнего слоя электронов атома свинца в основном состоянии.
Охарактеризуйте набором квантовых чисел каждую из 6р-орбиталей.
Какое максимальное число электронов может находиться в энергетическом 6р-состоянии?
Скачать решение задания 16 (методичка 140в) 50р
Задание 17
Известно, что при составлении электронной конфигурации атома учитывается принцип наименьшей энергии. Поясните, как согласно принципу наименьшей энергии, происходит заполнение электронными орбиталями атома олова.
Приведите электронную конфигурацию: а) атома олова и б) иона олова (II).
Охарактеризуйте набором квантовых чисел 7 s – орбиталь.
Какое максимальное число электронов может находиться в энергетическом 7 s- состоянии?
Скачать решение задания 17 (методичка 140в) 50р
Задание 18
Сформулируйте принцип Паули.
Какое максимальное число электронов может находиться в энергетических состояниях 1s, 2p, 3d, 4f?
Охарактеризуйте набором квантовых чисел каждую из 5f-орбиталей?
Приведите электронную конфигурацию: а) атома висмута, б) иона висмута (III) в основном состоянии.
Поясните, как согласно принципу Паули, происходит заполнение электронами орбиталей внешнего слоя атома висмута.
Скачать решение задания 18 (методичка 140в) 50р
Задание 19
Сформулируйте правило Хунда,
Атом какого элемента имеет электронную конфигурацию:
1s22s22p63s23p63d84s2
Поясните, как согласно правилу Хунда происходит заполнение электронами 3d- и 4s- орбиталей атома никеля.
Какое максимальное число электронов может находиться в энергетическом 3d - состоянии?
Опишите форму орбитали, характеризующейся квантовыми числами:
Скачать решение задания 19 (методичка 140в) 50р
Задача 20
Опишите форму орбитали, характеризующейся квантовыми числами: n = 4; l = 1, ml = 0, 1
Приведите электронную конфигурацию атома полония.
Составьте энергетическую схему распределения по орбиталям электронов атома полония.
Назовите суммарное спиновое число р-электронов внешнего слоя атома полония.
Какое максимальное число электронов может находиться в энергетическом 6d-состоянии?
Скачать решение задания 20 (методичка 140в) 50р
Задание 21
Постройте график зависимости значений атомной массы от порядкового номера элементов первого, второго и третьего периодов. Обоснуйте, почему атомная масса не является периодическим свойством элементов. Перечислите свойства элементов, которые носят периодический характер.
Скачать решение задания 21 (методичка 140в) 50р
Задание 22
Приведите валентные электронные конфигурации атомов ванадия и мышьяка. Сравните значения первой энергии ионизации атомов ванадия и мышьяка. Сделайте вывод, какому из этих элементов присущи металлические признаки в большей степени.
Скачать решение задания 22 (методичка 140в) 50р
Задание 23
Почему марганец и бром помещают в одну группу, но разные подгруппы периодической системы? В чем сходство и различие в химии этих элементов? Какие степени окисления наиболее устойчивы для: а) брома, б) марганца? Приведите формулы оксидов этих элементов в высших степенях окисления.
Скачать решение задания 23 (методичка 140в) 50р
Задание 24
Объясните особенности строения VIII группы периодической системы. Обоснуйте положение кобальта и никеля в этой группе, а также близость свойств триады железа. В обоснование ответа приведите валентные электронные конфигурации атомов, значения ra, Fu и примеры соединений в устойчивых степенях окисления.
Скачать решение задания 24 (методичка 140в) 50р
Задание 25
С какими элементами образует бинарные соединения водород в степени окисления –1? Приведите ряд гидридов элементов 2-го и 3-го периодов.
Скачать решение задания 25 (методичка 140в) 50р
Задание 26
Значения первой энергии ионизации атомов натрия и магния равны соответственно 495,8 и 737,7 кДж/моль, а значения второй энергии ионизации – 4565 и 1451 кДж/моль. Как можно объяснить резкое увеличение второй энергии ионизации атома натрия по сравнению с атомом магния? В обоснование ответа приведите электронные конфигурации этих атомов.
Скачать решение задания 26 (методичка 140в) 50р
Задание 27
Приведите валентные электронные конфигурации атомов семейства d-элементов 4-го периода. Какие свойства (металлов или неметаллов) проявляют простые вещества этих элементов? В обоснование ответа рассмотрите закономерности изменения первой энергии ионизации атомов в ряду К – Zn.
Скачать решение задания 27 (методичка 140в) 50р
Задание 28
На примере II группы покажите, на какие подгруппы и по какому принципу подразделяют элементы группы? Приведите валентные электронные конфигурации атомов. На примере элементов подгруппы кальция покажите вертикальное сходство в химии этих элементов. Приведите формулы их оксидов и гидроксидов. Как изменяются кислотно-основные свойства соединений этих элементов в подгруппе?
Скачать решение задания 8 (методичка 140в) 50р
Задание 29
Рассмотрите тенденции изменения 1) атомного радиуса, 2) энергии ионизации и 3) сродства к электрону элементов 3-го периода? Как изменяются свойства простых веществ этих элементов в периоде с увеличением порядкового номера? Приведите наиболее характерные степени окисления для элементов начала и конца периода.
Скачать решение задания 29 (методичка 140в) 50р
Задание 30
Дайте определение энергии сродства к электрону атома. Какова общая тенденция изменения сродства к электрону атомов: по периоду, в группах периодической системы? Почему сродство к электрону атомов гелия, азота, неона, магния близко к нулю? В обоснование ответа приведите валентные электронные конфигурации атомов этих элементов.
Скачать решение задания 30 (методичка 140в) 50р
Задание 31
Возможно ли существование отрицательно заряженных ионов Э– в невозбужденном состоянии следующих элементов: водорода; щелочных металлов; бериллия? Ответ обоснуйте.
Скачать решение задания 31 (методичка 140в) 50р
Задание 32
Приведите валентные электронные конфигурации атомов элементов V группы. На какие подгруппы можно поделить эту группу? Рассмотрите общие тенденции изменения атомного радиуса и энергии ионизации в подгруппах. У какого элемента подгруппы мышьяка сильнее выражены металлические свойства?
Скачать решение задания 32 (методичка 140в) 50р
Задание 33
Постройте графики зависимости изменения первой энергии ионизации и радиуса атомов р-элементов III группы от заряда ядра. Как можно объяснить немонотонный характер этих зависимостей?
B Al Ga In Tl
rорб, нм 0,078 0,126 0,126 0,138 0,132
Еи, эВ 8,298 5,98 6,09 5,78 6,11
Являются ли эти элементы полными электронными аналогами?
Скачать решение задания 33 (методичка 140в) 50р
Задание 34
Большинство элементов в периодической системе занимают места в порядке возрастания их атомной массы. Однако есть элементы, которые нарушают этот порядок. К ним относятся аргон и калий (порядковые номера 18 и 19), кобальт и никель (27 и 28), теллур и йод (52 и 53), протактиний и торий (90 и 91). Как можно объяснить этот факт? Какова современная формулировка периодического закона?
Скачать решение задания 34 (методичка 140в) 50р
Задание 35
Почему водород часто помещают как в первую, так и в седьмую группу периодической системы? Приведите электронную конфигурацию атома водорода и возможные степени окисления. Приведите ряд соединений водорода с элементами второго периода и укажите степени окисления элементов.
Скачать решение задания 35 (методичка 140в) 50р
