Задание 23 вар 2 Расчет материального баланса процесса получения |
||
| Синтез хлористого этила ведут путем барботирования этилена и хлористого водорода через жидкий хлористый этил, содержащий катализатор. При 35-40 С и давлении 3-5 ат. В пустотелой барботажной колонне протекает реакция: | ||
|
| ||
| ( ОХТ ) |
||
|
pуб 400
|
||
|
Расчет материального баланса процесса получения хлорэтила Синтез хлористого этила ведут путем барботирования этилена и хлористого водорода через жидкий хлористый этил, содержащий катализатор. При 35-40 °С и давлении 3-5 ат. В пустотелой барботажной колонне протекает реакция:  Теплота реакции отводится за счет испарения из реактора хлористого этила, часть которого конденсируют и возвращают в реактор для поддержания теплового баланса. Реакционные газы очищают от хлористого водорода, после чего хлористый этил выделяют охлаждением и абсорбцией. 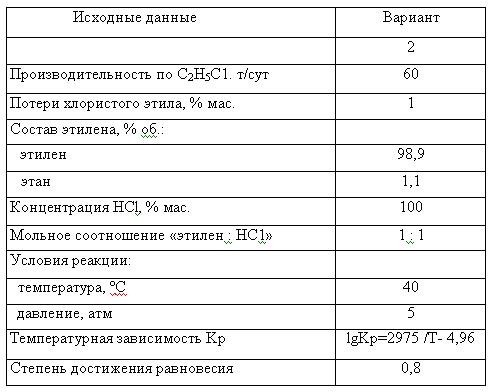 Работа выполнена по следующему плану в формете doc 1. Составлена технологическая, функциональная и операторная схему производства в виде эскизов, а также схема реатора 2. Составилен материальный баланс процесса (пояснения к расчету и таблица материального баланса приход/расход) 3. Рассчитаны технико-экономические параметры процесса а) производительность и пропускную способность б) выход продукта на поданное сырье. в) теоретический и фактический расходные коэффциенты по сырью. г) конверсия и селективность Файл помощи оформления заказа и порядок (инструкция) его получения Краткая теория При получении дихлорэтана взаимодействием этилена с хлором в среде жидкого дихлорэтана, который растворяет оба газа, реакция протекает фактически в жидкой фазе. Благодаря этому достигается безопасность процесса (смесь газообразных хлора и этилена взрывоопасна) и улучшаются условия теплопередачи от реакционной массы к охлаждающему агенту. Отвод реакционного тепла значительно облегчается, и полностью устраняется возможность местных перегревов. Кроме того, в среде дихлорэтана процесс протекает автокаталитически и скорость реакции значительно выше, чем при взаимодействии газообразных этилена и хлора. При взаимодействии этилена с хлором, кроме продукта присоединения хлора по двойной связи (1,2-дихлорэтана), образуются также продукты замещения - трихлорэтан, тетрахлорэтан и высшие полихлориды: Реакции замещения ускоряются с повышением температуры (рис. 1). Из рисунка видно, что при температурах от -30 до -20° С получается почти исключительно дихлорэтан, в то время как при +20°С образуется преимущественно трихлорэтан. При дальнейшем повышении температуры происходит более глубокое замещение с образованием тетрахлорэтана. Хлористый этил можно получать также хлорированием этана, которое осуществляют несколькими способами. В качестве катализатора хлорирования используют, например, тетраэтилсвинец. Хлор разбавляют инертным газом - азотом или двуокисью углерода. Реакция хлорирования активируется свободными этильными радикалами, образующимися в результате разложения тетраэтилсвинца. Объемное отношение хлор : этан : азот составляет 1 : 2 : 3. Температура реакции 130° С. При этом 95% хлора реагирует с образованием хлористого этила. Другим способом является хлорирование этана в газовой фазе в псевдоожиженном слое активного угля. Объемное отношение этан: хлор равно 3:1. Реакцию проводят при 450°С. Для предотвращения перегревов в зону реакции вводят азот. Хороший выход хлористого этила достигается при значительном избытке этана в реакционной смеси (примерно 8 объемов этана на 1 объем хлора). В качестве побочных продуктов образуются дихлорэтан и другие хлорпроизводные (5-7% от общего количества). |
||
|
|
||
Поиск, обзор и навигация
Магазин работ
ПиАХТ
Чертежи



