Задание 26 вар 2 Расчет материального баланса получения изопропа |
||
| Реакционные газы нейтрализуются раствором щелочи и в теплообменниках отдают свое тепло исходной смеси. В результате охлаждения образуется конденсат, который отделяют в сепараторе. Неконденсирующиеся газы дополнительно охлаждают и компрессором снова нап | ||
|
| ||
| ( ОХТ ) |
||
|
pуб 400
|
||
|
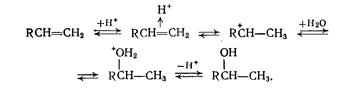
Расчет материального баланса получения изопропанола Свежую пропан-пропиленовую фракцию (ППФ) и рециркулирующий газ, сжатые до 8-15 МПа, смешивают с водой. Смесь подогревают до 200°С за счет горячих реакционных газов. Далее пары перегревают до 290°С в трубчатой печи и подают в гидрататор, где в присутствии гетерогенного катализатора протекает реакция  Реакционные газы нейтрализуются раствором щелочи и в теплообменниках отдают свое тепло исходной смеси. В результате охлаждения образуется конденсат, который отделяют в сепараторе. Неконденсирующиеся газы дополнительно охлаждают и компрессором снова направляют на реакцию. Водный раствор из сепаратора дросселируют до 0,5-0,6 МПа для отделения растворенных газов и направляют на ректификацию.  Работа выполнена по следующему плану в формете doc 1. Составлена технологическая, функциональная и операторная схему производства в виде эскизов, а также схема реатора 2. Составилен материальный баланс процесса (пояснения к расчету и таблица материального баланса приход/расход) 3. Рассчитаны технико-экономические параметры процесса а) производительность и пропускную способность б) выход продукта на поданное сырье. в) теоретический и фактический расходные коэффциенты по сырью. г) конверсия и селективность Файл помощи оформления заказа и порядок (инструкция) его получения Краткая теория Все рассматриваемые реакции принадлежат к числу кислотно-каталитических процессов. Типичными катализаторами гидратации являются достаточно сильные протонные кислоты: фосфорная кислота на носителе, поливольфрамовая кислота, сульфокатиониты. Для дегидратации используют фосфорную кислоту на носителе, оксид алюминия, серную кислоту, фосфаты (например, СаНРО4) и др. Роль катализаторов при гидратации состоит в протонировании олефина через промежуточное образование л- и а-комплексов, причем обратная реакция дегидратации идет через те же стадии, но в противоположном направлении:
При межмолекулярной дегидратации карбокатион не отщепляет протон, а взаимодействует с другой молекулой спирта: Электрофильный механизм гидратации олефинов определяет уже отмеченное выше направление присоединения по правилу Марковникова, а также изменение реакционной способности олефинов в следующем ряду третичный > вторичный > первичный определяемом сравнительной стабильностью промежуточных карбокатионов. Для разных условий и катализаторов отношение реакционных способностей олефинов меняется, составляя, например, для 80 %-ной серной кислоты 16000 : 1000 : 500: 1 и увеличиваясь для менее сильных кислот. Это очень существенно для выбора условий гидратации, особенно температуры: последняя может быть более низкой (и более благоприятной для равновесия) для изобутена по сравнению с пропиленом и особенно с этиленом. Равновесие гидратации - дегидратации, как мы видели выше, мало зависит от строения олефина и спирта, поэтому ряд реакционной способности олефинов к гидратации должен соответствовать аналогичному ряду спиртов по их способности к дегидратации: Эта способность особенно растет у (3-кето- и р-нитроспиртов, электроноакцепторные группы которых повышают кислотность атомов водорода, находящихся при соседнем с НО-группой углеродном атоме. |
||
|
|
||
Поиск, обзор и навигация
Магазин работ
ПиАХТ
Чертежи