Моделирование ХТП
Кинетическое моделирование гетерогенных реакций
Лабораторная работа № 1
Кинетическое моделирование гетерогенных реакций
Часть 1. Система с одной реакцией без изменения количества вещества.
Реакция водяного газа имеет место во многих процессах переработки природного газа, газификации угля и т.п.
CO2 + H2 = CO + H2O
Эта реакция достаточно изучена, известна зависимость константы ее равновесия от температуры.
В [1] исследовался синтез метанола на катализаторе со следующими характеристиками: состав Cu/ZnO/Al2O3, мольное отношение Cu/Zn/Al = 60/30/10, форма — цилиндрические гра-нулы 5 мм диаметром и 5 мм высотой. Было предложено описывать кинетику реакции водяного газа следующим уравнением
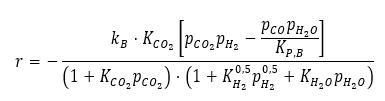
Константа скорости реакции (стадии, определяющей скорость) kB=1,16*1011 exp(-126573/RT)
Константа равновесия реакции KPB=10(-2090/T-2,018)
Константа адсорбции KCO2=1,02*10-6*exp(67439/RT)
Константа адсорбции KH2=2,71*102*exp(-6291/RT)
Константа адсорбции KH2O=3,8*10-10*exp(80876/RT)
1) Начальные мольные доли веществ: водорода — 0,58; CO — 0,06; CO2 — 0,09; вода — 0,27.
2) Давление — 4,5 МПа. Давление остается постоянным.
3) Температура — 220 °С. Температура остается постоянной.
4) Объем — 0,00001 м3.
5) Масса катализатора — 0,0075 кг (из расчета типовой насыпной плотности слоя такого катализатора 750 кг/м3).
Задание:
1. Ознакомьтесь с приближенным (численным) способом решения системы дифференциальных уравнений с использованием метода Эйлера.
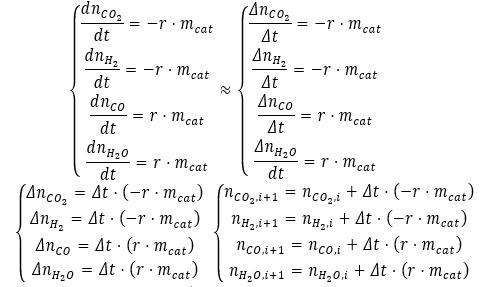
2. С использованием электронных таблиц решите кинетическую модель реакции водяного газа. Выберите как можно меньшее значение шага по времени.
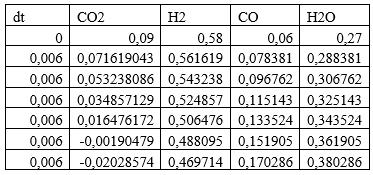
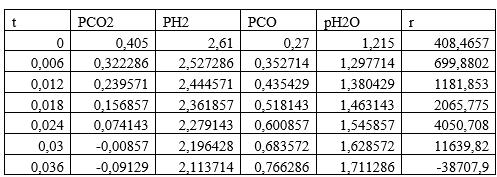
3. Изменяя исходные данные, оцените, в какой момент времени скорость реакции r уменьшается почти до нуля или меняет знак — это соответствует достижению химического равновесия. Какова степень конверсии сырья в этот момент времени? Каков состав смеси?
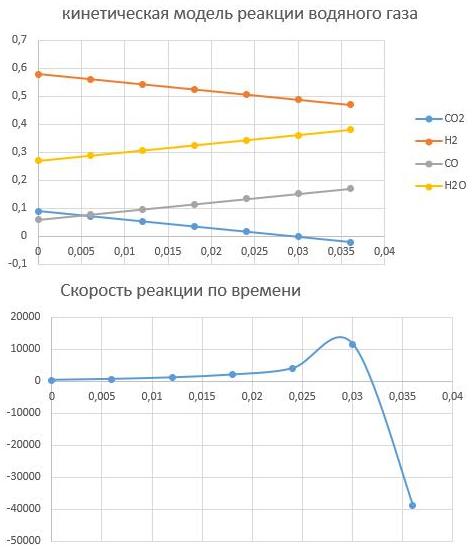
По графикам видно, что скорость останавливается при времени реакции t = 0,032с, при этом равновесный состав Н2 - 0,47; CO — 0,17; CO2 -0; вода — 0,36.Конверсия сырья
αH2=(0,58-0,47)/0,58=0,189=18,9 %
αCO2=(0,09-0)/0,09=1=100%
4. Зная время из п. 3, проведите параметрическое исследование — проварьируйте следу-ющие параметры:
— соотношение CO/CO2 в сырье;
При соотношении CO/CO2 в сырье в начальный момент времени 0,06/0,09 = 0,67
Увеличим CO/CO2 до 0,875, тогда состав станет
Н2 - 0,58; CO — 0,07; CO2 -0,08; вода — 0,27.
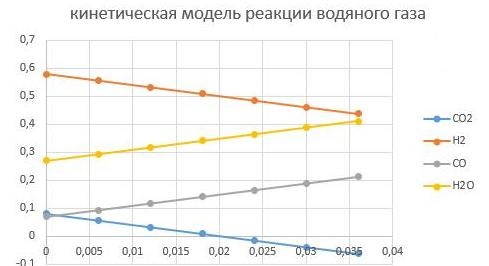
Видно, что так как СО2 стало меньше, то реакции прошла быстрее до полного превраще-ния СО2
давление Р = 2,5 МПа
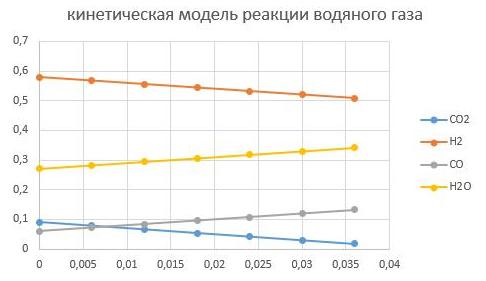
давление Р = 6,5 МПа
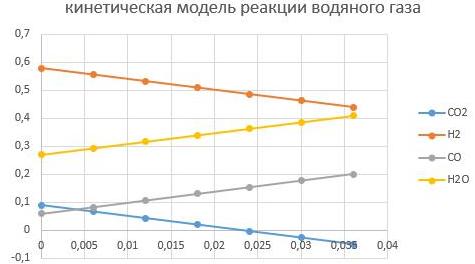
Видно, что увеличение давление способствует интенсифкации реакции
температура в пределах (200–400) °С;
При Т = 200°С
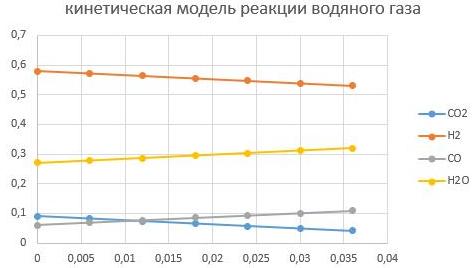
При Т = 400°С
Видно, что увеличение температуры способствует интенсифкации реакции
— масса катализатора в пределах (0,005–0,01) кг.
m_cat=0,005кг
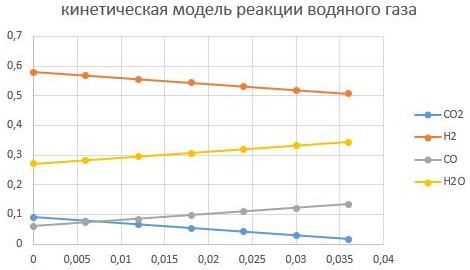
m_cat=0,01кг
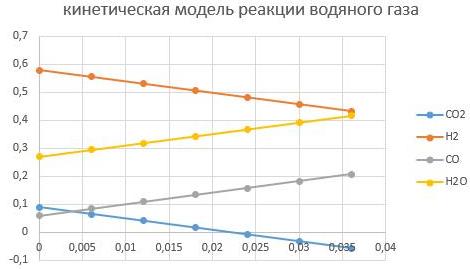
Видно, что увеличение массы катализатора способствует интенсифкации реакции
Часть 2. Система с несколькими реакциями.
Xu и Froment (1989a) [5] предложили для реакций в процессе конверсии водяного пара
СН4 + Н2О = СО + 3Н2 (1)
СО + Н2О = СО2 + Н2 (2)
СН4 + 2Н2О = СО2 + 4Н2 (3)
следующую кинетическую схему:

Используемый 13-ступенчатый механизм показывает конкуренцию за активные центры между метаном и паром.
Выражения для скоростей могут давать немонотонную зависимость скоростей реакций от парциального давления пара и метана.
Кинетическая модель для реакций (1–3) была составлена ими следующим образом:
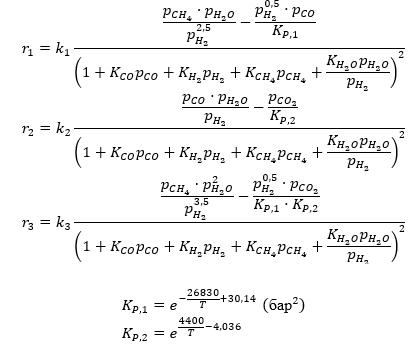
Таблица — Предэкспоненциальные множители для констант скоростей химических реакций, констант адсорбции, энергии активации и теплоты адсорбции
|
Константы |
Предэкспоненциальные множители А |
Энергии активации Ea реакций и теплоты адсорбции Q молекул, кДж/моль |
|
k1, (кмоль бар0,5)/(кг кат-ра ч) |
9,489 · 1015 |
240,10 |
|
k2, кмоль/(кг кат-ра ч бар) |
4,391 · 106 |
67,13 |
|
k3, (кмоль бар0,5)/(кг кат-ра ч) |
2,291 · 1015 |
243,90 |
|
KCO, бар–1 |
8,230 · 10–5 |
70,65 |
|
KCH4, бар–1 |
6,650 · 10–4 |
38,28 |
|
KH2O, бар–1 |
1,770 · 105 |
-88,68 |
|
KH2, бар–1 |
6,120 · 10–9 |
82,90 |
Температурные зависимости констант описываются аррениусовскими уравнениями:
— для констант скоростей ki=Ai⋅exp((-E_(a,i)/RT) )
— для констант адсорбции веществ Ki=Ai⋅exp(Q/RT).
Задание:
1. Повторите графики, полученные в [6, 7] по методу начальных скоростей (Приложение А):
— зависимости скоростей реакций (каждой по отдельности) от парциального давления водяного пара при разных температурах;
— зависимость суммарной скорости превращения метана от парциального давления водяного пара при разных температурах;
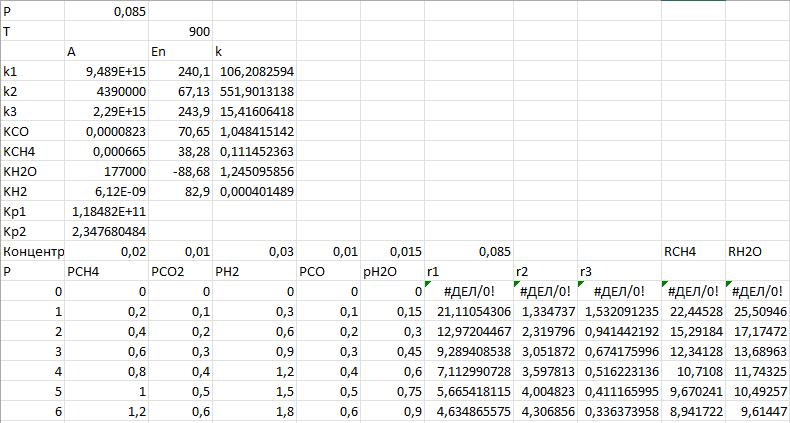
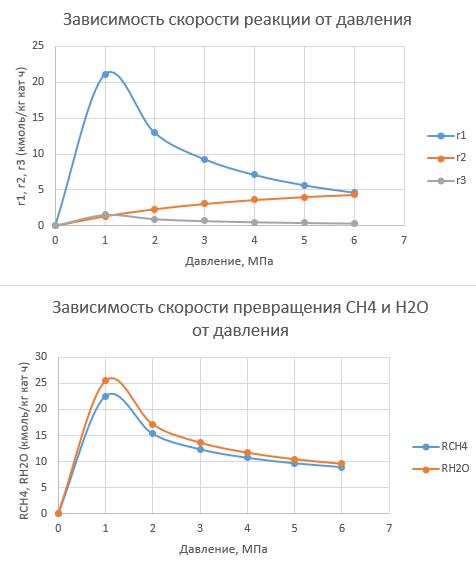
Проанализируйте полученные зависимости. Совпадают ли они с выводами, сделанными при обсуждении данной модели на лекции?
Обратите внимание: исходное парциальное давление пара изменяется, но парциальные давления других компонентов не меняются. Значит, и общее давление должно изменяться, и мольные доли веществ.
Исходные данные используйте из [7]: температуры — 900–1073 К, парциальные давления веществ (кроме водяного пара) — 0,1–0,3 бар.
1. Minji Son, Yesol Woo, Geunjae Kwak, Yun-Jo Lee, Myung-June Park. CFD modeling of a compact reactor for methanol synthesis: Maximizing productivity with increased thermal controllability. International Journal of Heat and Mass Transfer, Volume 145, 2019.
Задачи на моделирование (Термодинамика)
ДЗ1 Расчёт давления пара и точки кипения чистых веществ
1) Определите абсолютное давление в следующих ёмкостях:
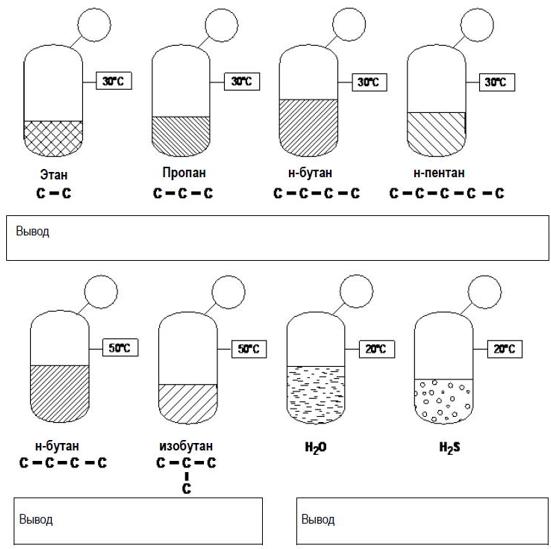
Определите (на основе разных кривых в Справочнике и уравнения Антуана) температуру кипения следующих веществ:
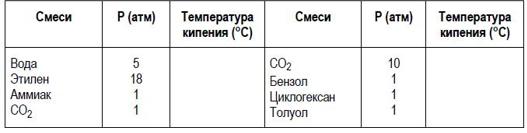
Скачать решение задачи ДЗ1 цена 200р
ДЗ2 Расчёт работы сжатия газа по уравнениям состояния
Имеется резервуар, который содержит 2 моль H2O при 1000 K. Рассчитайте, сколько требуется работы для изотермического и адиабатного сжатия этого газа от объема равного (2 + последняя цифра номера зачётной книжки) л до 1 л,
(а) Используя идеальную газовую модель для воды.
(б) Используя уравнение Редлиха-Квонга
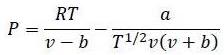
а = 14,24 Дж*К1/2*м3/моль2;
b = 2,11*10-5 м3/моль
Исходный объем V= 2+3 = 5 л
Скачать решение задачи ДЗ2 цена 100р
ДЗ3 Расчёт давления пара смеси углеводородов
Разделение парожидкостной смеси углеводородов F выполняется в сепараторе, как показано ниже:
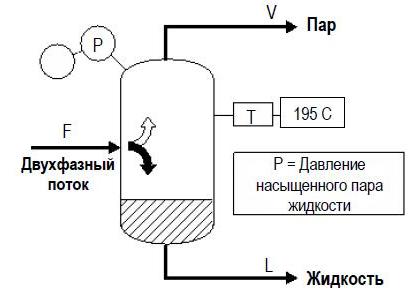
Сырье с расходом F частично испаряется, происходит разделение на две фазы:
– Пар V, выходящий из сепаратора является насыщенным.
– Жидкость L, выходящая из сепаратора является насыщенной. Она находится на уровне точки начала кипения.
Давление в сепараторе представляет собой давление насыщенного пара жидкости L. Для смесей углеводородов оно может быть рассчитано приближенно по закону Рауля, если молекулярный состав жидкости и температура в сепараторе известны, как указано в приведенном ниже примере.
Скачать решение задачи ДЗ3 цена 200р
ДЗ4 Расчёт давления пара смеси углеводородов
Рассчитайте температуру точки начала кипения следующей смеси при абсолютном давлении равном 2 умножить на последнюю цифру номера зачётной книжки) атм, считая парожидкостную систему идеальной.
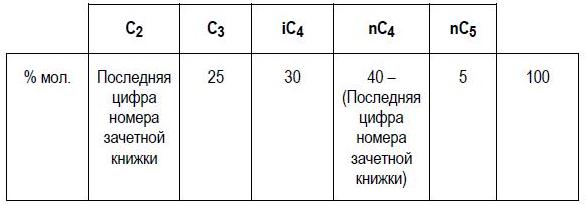
Р = 2·3 = 6 атм
Скачать решение задачи ДЗ4 цена 200р
ДЗ5 Расчёт фазовой диаграммы бинарной смеси углеводородов
– Рассчитайте и нарисуйте (на 2 странице) изобарическую диаграмму равновесия для двухкомпонентной смеси изобутана и н-бутана при абсолютном давлении 5 атм (используйте значения коэффициента фазового равновесия Шейбеля и Дженни из номограммы на 3 странице). Все расчёты приведите на отдельной странице.
– Сделайте вывод о разделении iC4-nC4?
По диаграмме Шейбеля и Дженни
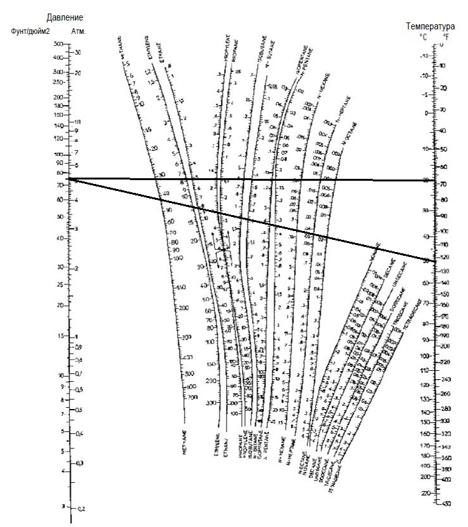
Скачать решение задачи ДЗ5 цена 200р
ДЗ6 Расчёт сепаратора
A - РАСЧЕТ ПО ФРАКЦИЯМ
Установка, показанная ниже, предназначена для сжатия, а затем охлаждения нефтезаводского газа для извлечения СНГ (C3 и C4) в жидкой фазе.
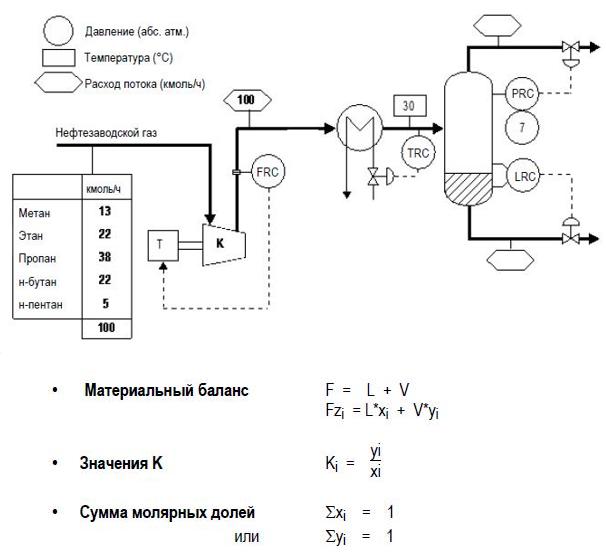
А) Рассчитайте степень извлечения СНГ. Всё расчёты по пункту А привести на отдельной странице.
Б) Расход бензиновой фракции (чистого н-гептана) равен 10 умножить на последнюю цифру номера зачётной книжки.
В) Рассчитайте степень извлечения СНГ. Сравните со случаем А. Всё расчёты по пункту Б и вывод по заданиям А и Б привести на отдельной странице.
Скачать решение задачи ДЗ6 цена 200р
ДЗ7 Расчёт условий появления азеотропа в смеси двух веществ
Имеется смесь 1-пропанола (а) с водой (b). Используя двухпараметрическую модель Маргулеса с указанными параметрами
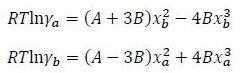
А = 4640 Дж/моль
В = -1700 Дж/моль
определите формирует ли данная смесь азеотроп при температуре (10 + 2*(последняя цифра номера зачётной книжки)) оС. Если да, то при каком давлении появляется азеотроп?
T = 10+2*3 = 16ºC
Скачать решение задачи ДЗ7 цена 200р
Математическое моделирование химико-технологических процессов
Задача 1.1 В таблице 1.1 приведены данные разгонки широкой бензиново фракции. Постройте серию эмпирических моделей в виде алгебраических степенных полиномов от первой до 5 степени. Оцените адекватность каждой модели, рассчитав коэффициент детерминации, остаточную сумму.
Таблица 1.1 (начало)
|
Доля отгона, % |
2,84 |
6,19 |
10,22 |
15,09 |
20,82 |
27,15 |
33,68 |
40,10 |
46,36 |
52,53 |
|
ТНК, оС |
0.2 |
11.4 |
22.6 |
33.8 |
44.9 |
56.1 |
67.3 |
78.5 |
89.7 |
100.8 |
Таблица 1.1 (продолжение)
|
Доля отгона, % |
58,69 |
64,89 |
71,09 |
77,07 |
82,53 |
87,25 |
91,25 |
94,63 |
97,51 |
|
ТНК, оС |
112 |
123.2 |
134.4 |
145.6 |
156.7 |
167.9 |
179.1 |
190.3 |
201.5 |
Скачать задачу 1.1 (моделирование процессов) цена 100р
Задача 1.2 По приведенным в Таблице 1.2 данным зависимости плотности указанных жидкостей от температуры построить эмпирическую модель и оценить её адекватность. Задача выполняется по вариантам. Вариант выбирается согласно последней цифре в номере зачётной книжки.
Таблица 1.2 - Плотность в кг/м3 при указанной температуре в ºС
|
Вар |
Вещество |
-20 |
0 |
20 |
40 |
60 |
80 |
100 |
120 |
|
0 |
Ацетон |
835 |
813 |
791 |
768 |
746 |
719 |
693 |
665 |
Скачать задачу 1.2 (моделирование процессов) цена 100р
Задача 1.3 В Таблице 1.3 приведены зависимости вязкости жидкости от температуры для ряда веществ. Постройте по приведенным данным эмпирическую модель. Оцените адекватность модели, рассчитав коэффициент детерминации, остаточную сумму. Постройте график остатков. Задача выполняется по вариантам. Вариант выбирается согласно последней цифре в номере зачётной книжки.
Таблица 1.3 - Динамическая вязкость в мПа*с при указанной температуре в ºС
|
Вещ-во |
Динамическая вязкость в мПа*с при указанной температуре в °С |
|||||||||||
|
-20 |
-10 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
80 |
100 |
120 |
|
|
Ацетон |
0,5 |
0,442 |
0,395 |
0,356 |
0,322 |
0,293 |
0,268 |
0,246 |
0,23 |
0,2 |
0,17 |
0,15 |
Постройте по приведенным данным эмпирическую модель. Оцените адекватность модели, рассчитав коэффициент детерминации, остаточную сумму. Постройте график остатков.
Скачать задачу 1.3 (моделирование процессов) цена 100р
Задача 1.4 В Таблице 1.4 приведены зависимости удельной теплоты парообразования (в кДж/кг) от температуры (в оС) для ряда веществ. Постройте по приведенным данным эмпирическую модель. Оцените адекватность модели, рассчитав коэффициент детерминации, остаточную сумму. Постройте график остатков. Задача выполняется по вариантам. Вариант выбирается согласно последней цифре в номере зачётной книжки.
Таблица 1.4 - Теплота парообразования кДж/кг от температуры в ºС
|
Вар |
Вещ-во |
0 |
20 |
60 |
100 |
140 |
|
0 |
Ацетон |
566 |
553 |
520 |
474 |
- |
Постройте по приведенным данным эмпирическую модель. Оцените адекватность модели, рассчитав коэффициент детерминации, остаточную сумму. Постройте график остатков.
Скачать задачу 1.4 (моделирование процессов) цена 100р
Задача 1.5 Зависимость константы скорости реакции от температуры для ряда веществ приведена в Таблице 1.5. Рассмотрите возможность описания этой зависимости уравнением Аррениуса. По приведенным данным определите константы уравнения Аррениуса – энергию активации и предэкспоненциальный фактор. Задача выполняется по вариантам. Вариант выбирается согласно последней цифре в номере зачётной книжки.
Таблица 1.5 - Константа скорости реакции в с-1 от температуры в ºС
|
Вар |
100 |
150 |
200 |
250 |
300 |
350 |
400 |
450 |
500 |
|
0 |
0,05 |
0,25 |
0,6 |
0,98 |
1,35 |
1,99 |
2,87 |
4,56 |
8,43 |
Скачать задачу 1.5 (моделирование процессов) цена 100р
Задача 1.6. В таблице 1.6. приведена зависимость теплоемкости газов от температуры для ряда веществ. Постройте по приведенным данным эмпирическую модель. Оцените адекватность модели, рассчитав коэффициент детерминации, остаточную сумму. Постройте график остатков. Задача выполняется по вариантам. Вариант выбирается согласно последней цифре в номере зачётной книжки.
|
Вар |
Вещество |
Теплоемкость в кДж/кг*К от температуры в К |
|||||||
|
273 |
300 |
500 |
700 |
900 |
1100 |
1300 |
1500 |
||
|
0 |
О2 |
0,9148 |
0,9169 |
0,9391 |
0,9688 |
0,996 |
1,0182 |
1,0371 |
1,053 |
Скачать задачу 1.6 (моделирование процессов) цена 100р
2 Физические свойства чистых веществ – уравнения состояния
Задача 2.1 Найти удельный объем н-бутана при температуре 393.3 К и давлении 16.6 атм, используя уравнение состояния Рейндлиха-Квонга. Молекула н-бутана имеет симметричное строение, поэтому уравнение Рейндлиха-Квонга должно дать результат, близкий к экспериментальному (уравнения Соаве-Рейндлиха-Квонга и Пенга-Робинсона использовать необязательно). Так как давление выше 10 атм, можно ожидать существенных отклонений от закона идеального газа. Критические параметры бутана: Tc = 425.2 K, Pc = 37.5 атм.
Скачать задачу 2.1 (моделирование процессов) цена 100р
Задача 2.2 Определите молярный объем аммиака при давлении 56 атм и температуре 450 К, используя уравнение Рейндлиха-Квонга. Критические показатели для аммиака TС = 405.5 К, РС = 111.3 атм, a = 4.2527, b = 0.02590. Единицы измерения a и b соответствуют v, измеряемому в л/(г моль).
Скачать задачу 2.2 (моделирование процессов) цена 100р
Задача 2.3 Решите задачу №2.2, используя уравнения Соаве-Рейндлиха-Квонга и Пенга- Робинсона. Ацентрический фактор для молекулы аммиака принять равным 0.25. Объясните различия.
Скачать задачу 2.3 (моделирование процессов) цена 100р
Задача 2.4 Имеется смесь, состоящая из 25% аммиака, а оставшиеся азот и водород находятся в мольном соотношении 1:3. Газ находится при давлении 270 атм и температуре 550 К. Рассчитайте мольный объем смеси, используя уравнения идеального газа, Рейндлиха-Квонга и Соаве-Рейндлиха-Квонга. Сравните результаты. Объясните различия. Является ли газ идеальным?
Скачать задачу 2.4 (моделирование процессов) цена 100р
Задача 2.5 Определите молярный объем метанола при давлении 100 атм и температуре 300 °С, используя уравнение Соаве-Рейндлиха-Квонга. Критические показатели для метанола TС = 512.6 К, РС = 79.9 атм, a = 8.96, b = 0.04561, ω = 0.559. Единицы измерения a и b соответствуют v, измеряемому в л/(г моль). Объясните почему в данном случае не подходят уравнения идеального газа и Рейндлиха-Квонга. Дополнительные сведения: при давлении 9.174 МПа и температуре 300 °С мольный объем метанола составляет 0.373 л/(г моль).
Скачать задачу 2.5 (моделирование процессов) цена 100р
Задача 2.6 Имеется смесь на выходе из реактора для синтеза метанола: СО – 100, Н2 – 200, метанол – 100 кмоль/ч. Газ находится при давлении 100 атм и температуре 300 °С. Рассчитайте мольный объем смеси, используя уравнения идеального газа, Рейндлиха-Квонга и Соаве-Рейндлиха-Квонга. Объясните различие результатов. Почему уравнения идеального газа и РК дают неверные результаты. Ацентрические факторы: СО – 0.049, Н2 – 0.22, метанол – 0.559.
Скачать задачу 2.6 (моделирование процессов) цена 100р
3 Равновесие «пар-жидкость»
Задача №3.1. Провести расчёт сепарационного блока (на рисунке) процесса разделения многокомпонентной углеводородной смеси (рассчитать состав и количество газовых и жидких потоков на выходе из каждого сепаратора) и исследовать влияние технологических параметров на процесс сепарации.
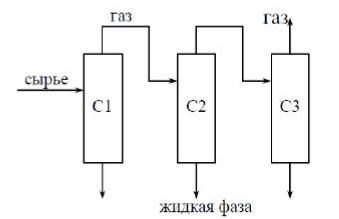
Рис. 3.1 - Принципиальная схема сепарационного блока. С – это сепараторы.
Таблица 3.1. Исходные данные для расчета процесса сепарации
|
Компонент |
Мольная масса |
Мол масса |
Плотность газа, кг/м3 |
Плотность жидкости, кг/м3 |
Темп. кипения, ºС |
Критическая темп-ра, К |
Критическое давление, атм |
|
CO2 |
0,00538 |
4 |
1,9650 |
859 |
-78,2 |
304,2 |
72,83 |
|
N2 |
0,02648 |
28 |
1,2510 |
570 |
-195,8 |
126,2 |
33,5 |
|
CH4 |
0,8486 |
16 |
0,7162 |
300 |
-161,58 |
190,6 |
45,4 |
|
C2H6 |
0,0424 |
30 |
0,3420 |
460 |
-88,7 |
305,4 |
48,2 |
|
C3H8 |
0,2628 |
44 |
1,969 |
501 |
-42,06 |
369,8 |
41,9 |
|
i-C4 |
0,00759 |
58 |
2,5948 |
557 |
-11,73 |
408,1 |
36 |
|
C4 |
0,00548 |
58 |
2,5948 |
580 |
-0,5 |
425,9 |
37,5 |
|
C5 |
0,0083 |
72 |
3,22 |
616 |
36,1 |
469,6 |
33,3 |
|
Остаток |
0,02692 |
108 |
3,88 |
721 |
100,7 |
537,3 |
28 |
|
H2O |
0,00358 |
18 |
0,804 |
1000 |
100 |
647,3 |
217,6 |
|
CH3OH |
0,00085 |
32 |
2,678 |
791 |
64,65 |
512,6 |
79,9 |
Базовые термобарические условия в сепараторах:
P1 = 13,8 МПа, Т1 = 21.8 ºС (сепаратор С1);
P2 = 9,7 МПа, Т2 = 8.6 ºС (сепаратор С2);
P3 = 5,4 МПа, Т3 = 34.8 ºС (сепаратор С3).
После выполнения базового расчёта необходимо исследовать влияние технологических параметров на процесс сепарации согласно своему варианту. Вариант выбирается по последнему числу номера зачётной книжки.
Вариант 0 Исследовать влияние температуры в первом сепараторе
Скачать задачу 3.1 (моделирование процессов) цена 200р
4 Гидродинамические модели
Задача 4.1 (вар 8) Через насадочный аппарат длиной L = 10 м, внутренним диаметром d = 0,065 м и коэффициентом заполнения насадкой ϕ=0,67 протекает жидкость с объемной скоростью v = 0,001 м3/с. Построить математическую модель структуры гидродинамического потока в аппарате.
|
t, c |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
c |
0 |
0,1 |
1,1 |
3,6 |
7,2 |
11,3 |
14,9 |
17,6 |
19,1 |
19,5 |
продолжение таблицы
|
10 |
12 |
14 |
16 |
18 |
20 |
22 |
24 |
26 |
29 |
30 |
|
19 |
16 |
12,1 |
8,4 |
5,4 |
3,4 |
2 |
1,2 |
0,6 |
0,8 |
0,5 |
Скачать задачу 4.1 (моделирование процессов) цена 200р
Задача 4.2 Построить ячеечную модель гидродинамики насадочного абсорбера по газовому потоку. Высота насадки 11.5 м, площадь поперечного сечения абсорбционной колонны 1.8 м2, объемная скорость потока 10 000 м3/ч.
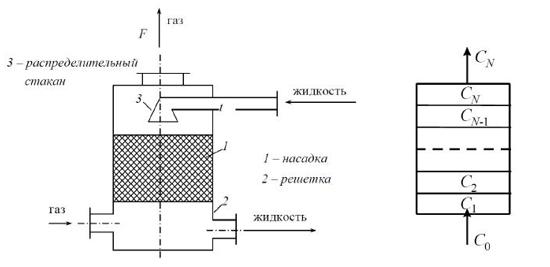
Рис. 4.2. Насадочный абсорбер и его ячеечная схема.
Начальная концентрация абсорбируемого компонента в газовом потоке и экспериментальная кривая абсорбции (зависимость концентрации компонента на выходе из колонны от времени) приведены в таблице 4.2. Вариант выбирается по последнему числу номера зачётной книжки. Необходимо выполнить расчёты при разных значениях числа ячеек ячеечной модели и выбрать оптимальное число ячеек. Сделать вывод.
Начальная концентрация абсорбируемого компонента в % (об.) 0,155
|
Время, с |
вар 0 |
|
0 |
0 |
|
1 |
0,0025 |
|
2 |
0,01 |
|
3 |
0,026 |
|
4 |
0,049 |
|
5 |
0,072 |
|
6 |
0,09 |
|
7 |
0,115 |
|
8 |
0,13 |
|
9 |
0,146 |
|
10 |
0,154 |
Скачать задачу 4.2 (моделирование процессов) цена 200р
Задача 5.1 В теплообменнике типа «труба в трубе» охлаждается жидкость. Хладоагент и охлаждающаяся жидкость движутся прямотоком. Построить математическую модель теплообменного аппарата. Определить температуру теплоносителей на выходе из аппарата. Построить температурные профили по длине аппарата. Исходные данные приведены в таблице 5.1.
Таблица 5.1 – Исходные данные
|
Вариант |
Теплоноситель |
Начальная температура, ºС |
Объёмный расход, м3/с |
Плотность, кг/м3 |
Теплоёмкость, Дж/кг ºС
|
|
10 |
Горячий Холодный |
220 35 |
2,4*10-4 5,5*10-4 |
900 990 |
3.53*103 4.0*103 |
Исследования по длине теплообменника проводятся с целью определения длины, необходимой для завершения процесса теплообмена. Длину теплообменника увеличивают до тех пор, пока процесс теплообмена практически не завершится, т. е. пока разность температур горячего теплоносителя и хладоагента не достигнет 1.5–2 ºС.
Дополнительно нужно исследовать влияние температуры и расхода теплоносителя и хладоагента. Исследования по изменению температуры проводятся с целью изучения влияния температуры хладоагента на расход хладоагента. После изменения температуры хладоагента изменяют расход хладоагента до тех пор, пока конечные температуры горячего теплоносителя и хладоагента не достигнут требуемых значений.
Скачать задачу 5.1 (моделирование процессов) цена 200р
Вопросы ОХТ часть 5
172 Проектный анализ
173 Материальные балансы периодического идеального реактора
174 Основные блоки схем и их значение. Структура технологической схемы, основные типы связей блоков и аппаратов в схеме.
175 Расчет периодического адиабатического реактора, тепловой баланс
176 Организация проектирования. Участники процесса проектирования и строительства. Функции и обязанности генерального проектировщика
177 Теплообмен в химических реакторах, классификация методов подвода и отвода тепла и организация теплообмена.
178 Принципы экологической экспертизы
179 Непрерывные реакторы для гомогенных и гомофазных процессов. Примеры аппаратов в производстве органических веществ.
180 Общие принципы построения технологических схем
181 Расчет периодического адиабатического реактора, тепловой баланс
182 Этапы проведения экологической экспертизы.
183 Расчет непрерывных, идеальных изотермических гомогенных реакторов. Расчет гидравлического сопротивления.
184 Экологическое обоснование проектов химических производств. Этапы проведения экологической экспертизы. Принципы экологической экспертизы. Общая характеристика реакционной аппаратуры производства ООС. Особенности аппаратурного оформления процессов производств органических веществ.
185 Тепловой баланс химического реактора
186 Составные части проектирования
187 Этапы реализации прединвестиционной фазы. Предпроектная документация.
188 Расчет периодических и непрерывных гомогенных реакторов по данным действующих установок
189 Катализ. Основные стадии и кинетические особенности гетерогенных каталитических процессов. Механизм стадий.
190 Способы изменения скорости простых и сложных реакций
191 Управление обратимыми реакциями. Факторы, влияющие на скорость реакции и положение равновесия. Принцип Ле-Шателье.
192 Деструктивные методы переработки нефти. Термические процессы. Коксование: сырье, условия процесса продукты коксования
193 Описание методов очистки промышленных газов от сероводорода
194 Этиленовые установки пиролиза углеводородов.
195 Получение уксусной кислоты
196 Осушка газа на адсорбентах
197 Гидропиролиз нефтепродуктов
198 Производство метанола
199 Элементный и вещественный состав человека и растений. Основа обмена веществ.
200 Движение фосфора в почве, растениях и живом организме.
201 Что такое химический процесс? Почему химический процесс, как единый процесс химической технологии, сложнее по сравнению с тепловыми и массообменными?
202 Из каких основных стадий состоит химико-технологический процесс (ХТП)? В каких стадиях химико-технологического процесса участвуют химические реакции?
203 Классификация химических реакций, лежащих в основе промышленных химико-технологических процессов.
204 Скорость гомогенных химических реакций. Факторы, влияющие на кинетику процесса. Закон действующих масс. Уравнение Аррениуса.
205 Реактор идеального смешения непрерывного действия. Уравнение материального баланса и расчеты на его основе (определение среднего времени пребывания реагента в объеме реактора).
206 Технология получения азотной кислоты
207 Экологические аспекты при проектировании новых и реконструкции действующих химических производств. Создание безотходных и малоотходных производств.
208 Как определить направленность химической реакции? Как, сравнивая значения энергии Гиббса ∆G для различных реакций, можно определить, какая из них является спонтанной (самопроизвольной)?
209 Какие вещества называются катализаторами?
210 Составьте уравнение материального баланса реактора идеального вытеснения. Какие явления переноса (переноса импульса, переноса теплоты, массопереноса) отражены в этом уравнении?
211 Что такое химико-технологическая система (ХТС)?
212 Какой эффект дает последовательное соединение реакторов вытеснения; реакторов смешения? В каких случаях в химических производствах целесообразно применять последовательное соединение аппаратов?
213 Реакторы с использованием дугового разряда
214 Технико-экономические показатели химико-технических процессов.
215 Безысходные и малоотходные производства в химической промышленности.
216 Вторичные процессы нефтепереработки: алкилирование, дегидрирование алканов, изомеризация.
217 Гетерогенные процессы: общая характеристика и особенности. Аппаратурное оформление гетерогенных некаталитических процессов в системе «газ – твердое тело», «газ – жидкость».
218 Виды каталитических процессов, их характеристика.
219 Какие насосы используются для перекачивания высоковязких жидкостей?
220 Перечислите основные требования к абсорбционным аппаратам. Дайте их классификацию.
221 Опишите устройство, раскройте принцип действия аппаратов для растворения и экстрагирования из твердых тел.
Контрольная по ТОВ
222 (вопрос 1 вар 3 кр 1) Возможные пути регулирования селективности (состав продуктов) при хлорировании насыщенных, ненасыщенных и ароматических углеводородов
223 (вопрос 2 вар 3 кр 1) Каталитическое хлорирование по С-С и С = С – связям
224 (вопрос 3 вар 3 кр 1) Гидратация олефинов (этилен, пропилен). Технологическая схема получения этанола прямой гидратацией этилена
225 (вопрос 1 вар 5 кр 1) Нитрование ароматических соединений. Аппаратурное оформление процесса нитрования. Технология нитрования бензола.
226 (вопрос 2 вар 5 кр 1) Сульфирование ароматических соединений (бензол, нафталин, хлорбензол, толуол, нитротолуол и др.)
227 (вопрос 3 вар 5 кр 1) Альдольная конденсация, получаемые продукты
228 (вопрос 1 вар 7 кр 1) Дегидратация амидов и гидратация нитрилов. Получаемые продукты
229 (вопрос 2 вар 7 кр 1) Сульфохлорирование парафинов. Технологическая схема получения алкансульфонатов
230 (вопрос 3 вар 7 кр 1) Конденсация альдегидов и кетонов с основаниями
231 (вопрос 1 вар 11 кр 1) Нитрование парафинов и олефинов
232 (вопрос 2 вар 11 кр 1) Сульфоокисление парафинов и технологическая схема получения алкилсульфонатов
233 (вопрос 3 вар 11 кр 1) Синтез ацеталей. Реакция Принса.
234 (вопрос 1 вар 15 кр 1) Хлорирование ароматических соединений в ядро, получаемые продукты и их значение.
235 (вопрос 2 вар 15 кр 1) Существующие способы получения хлористого винила. Технологическая схема комбинированного метода.
236 (вопрос 3 вар 15 кр 1) Гидролиз и щелочное дегидрогалогенирование галогензамещенных алифатических и ароматических углеводородов
237 (вопрос 1 вар 3 кр 1) Значения реакций хлоргидринирования, получаемые продукты.
238 (вопрос 1 вар 3 кр 1) Значения реакций хлорметилирования ароматических соединений.
239 (вопрос 1 вар 3 кр 1) Гидролиз простых и сложных эфиров, амидов и нитрилов
240 (вопрос 1 вар 19 кр 1) Хлорирование и гидрохлорирование спиртов, альдегидов и кетонов. Технология получения хлораля.
241 (вопрос 2 вар 19 кр 1) Гидратация олефинов, дегидратация спиртов, механизм.
242 (вопрос 3 вар 19 кр 1) Окислительное хлорирование и сочетание его с процессами хлорирования. Технология получения хлористого винила данным методом.
243 (вопрос 1 вар 3 кр 2) Методы получения меламина, его назначения.
244 (вопрос 2 вар 3 кр 2) Существующие методы сульфатирования спиртов. Технологическая схема производства алкилсульфатов
245 (вопрос 3 вар 3 кр 2) Существующие методы получения изопрена. Технологическая схема получения изопрена по реакции Принса.
246 (вопрос 1 вар 5 кр 2) Хлорирование ароматических соединений в ядро, получаемые продукты и их значение.
247 (вопрос 2 вар 5 кр 2) Процессы расщепления хлорзамещенных и их сочетание с процессами хлорирования
248 (вопрос 3 вар 5 кр 2) Гидролиз простых и сложных эфиров, амидов и нитрилов
249 (вопрос 1 вар 7 кр 2) Газофазное радикально-цепное хлорирование. Технология получения аллилхлорида
250 (вопрос 2 вар 7 кр 2) Окислительное хлорирование и сочетание его с процессами хлорирования. Технологическая схема сбалансированного по хлору метода получения хлористого винила
251 (вопрос 3 вар 7 кр 2) Внутри молекулярная и межмолекулярная дегидратация гидроксилсодержащих продуктов (спирты, кислоты)
252 (вопрос 1 вар 11 кр 2) Каталитическое хлорирование по С-С и С =С связям
253 (вопрос 2 вар 11 кр 2) Значение реакций хлорметилирования ароматических соединений
254 (вопрос 3 вар 11 кр 2) Гидролиз и щелочное дегидрогалогенирование галогензамещенных алифатических и ароматических углеводородов
255 (вопрос 1 вар 13 кр 2) Нитрование ароматических соединений. Аппаратурное оформление процесса нитрования. Технология нитрования бензола.
256 (вопрос 2 вар 13 кр 2) Существующие методы сульфатирования спиртов. Технологическая схема производства алкилсульфатов
257 (вопрос 3 вар 13 кр 2) Реакция альдегидов и кетонов со слабыми кислотами (нитросоединениями, цианистым водородом и ацетиленом)
258 (вопрос 1 вар 15 кр 2) Методы синтеза капролактама. Полиамидные смолы
259 (вопрос 2 вар 15 кр 2) Процессы сульфатирования, сульфирования, сульфохлорирования, сульфоокисления.
260 (вопрос 3 вар 15 кр 2) Значение реакций поликонденсации
261 (вопрос 1 вар 18 кр 2) Нитрование ароматических соединений. Аппаратурное оформление процесса нитрования. Технология нитрования бензола.
262 (вопрос 2 вар 18 кр 2) Сульфоокисление парафинов и технологическая схема получения алкилсульфонатов.
263 (вопрос 1 вар 19 кр 2) Синтез и превращения азотопроизводных угольной кислоты
264 (вопрос 2 вар 19 кр 2) Сульфирование ароматических соединений (бензол, нафталин, хлорбензол, толуол, нитротолуол и др.)
265 (вопрос 3 вар 19 кр 2) Существующие методы получения изопрена. Технологическая схема получения изопрена по реакции Принса.
266 (вопрос 1 вар 5 ХОВ) Олефины. Процессы крекинга и пиролиза углеводородов. Механизм первичные и вторичные реакции. Факторы, влияющие на эти процессы. Образующиеся продукты. Технология пиролиза углеводородов.
267 (вопрос 2 вар 5 ХОВ) Алкилирование ароматических углеводородов. Химия и технология алкилирования бензола этиленом.
268 (вопрос 3 вар 5 ХОВ) Технико-экономическая характеристика различных методов получения дивинила.
Прикладная химия ПХ
269 (вар 10) Риформинг. Химические реакции риформинга
270 (вар 10) Технология газофазного гидрирования
271 (вар 10) Синтезы на основе синтез газа и оксида углерода. Синтез углеводородов
272 (вар 10) Производство пропиленоксида и стирола Халкон-методом
273 (вар 53) Методы получения высших олефинов. Реакция Циглера
274 (вар 53) Алкилирование по атому азота. Синтез аминов из хлорпроизводных
275 (вар 4) Олефины. Пиролиз. Химические реакции, протекающие при пиролизе.
276 (вар 4) Дегидрирование алкилароматических углеводородов.
277 (вар 4) Окисление олефинов с сохранением двойной связи.
278 (вар 4) Производство стирола
279 (вар 5) Пиролиз. Факторы, влияющие на процесс пиролиза
280 (вар 5) Гидрирование альдегидов и кетонов
281 (вар 5) Получениа а-оксидов. Получение окиси этилена
282 (вар 6) Высшие олефины. Получение высших олефинов
283 (вар 6) О-алкилирование
284 (вар 6) Окислительный аммонолиз
285 (вар 6) Производство ацетилена
286 (вар 9) Ароматические углеводороды. Получение ароматических углеводородов
287 (вар 9) Технология жидкофазного гидрирования
288 (вар 9) Окисление алкилароматических углеводородов
289 (вар 11) История развития химической промышленности
290 (вар 11) Двухстадийное дегидрирование парафинов
291 (вар 11) Окисление олефинов перуксусной кислотой, гидропероксидами
292 (вар 21) Риформинг. Технологическая схема
293 (вар 21) Дегидрирование, гидрирование. Катализаторы, механизм селективность
294 (вар 21) Окисление парафинов
295 (вар 23) Получение ацетилена из углеводородов
296 (вар 23) Гидрирование. Гидрирование углеводородов
297 (вар 23) Производство фенола и ацетона кумольным методом. Технологическая схема
298 (вар 87) Получение синтез-газа. Технологическая схема окислительной конверсии
299 (вар 87) S-алкилирование
300 (вар 87) Оксосинтез
301 (вар 87) Производство метиламинов
302 (вар 99) Гидрирование нитрилов
303 (вар 99) Оксиалкилирование. Технологическая схема получения этиленгликоля
304 (вар 99) Окисление альдегидов, спиртов
305 (вар 99) Производство бутиловых эфиров
306 Рассмотреть карбкатионный механизм возможных путей превращения
н-пропилциклогексана в каталитическом риформинге
307 Напишите превращение этилциклогексана в термических процессах
308 Химический состав нефти. Жидкие алканы; нормального строения и изостроения. Напишите и назовите представителей
309 Физико-химические свойства нефти. Цвет от чего зависит?
310 Укажите страны мира с развитой ядерной и гидроэнергетикой.
311 Основные технологические процессы переработки нефти и газа.
312 Приведите технологическую схему установки (секции) ЭЛОУ.
313 Дайте классификацию контактных устройств массообменных процессов и их краткую характеристику.
314 Приведите принципиальную схему одно- и двухколонной вакуумной перегонки по масляному варианту. Опишите технологический процесс.
315 Каковы целевое назначение термокрекинга дистиллятного сырья (ТК ДС) и требования к термогазойлю?
316 Каково целевое назначение и сырье процессов пиролиза?
317 Дайте характеристику цеолитам и промышленным катализаторам крекинга.
318 Приведите технологическую схему (ее работу) и технологический режим установки получения серы по методу Клауса.
319 Каковы целевое назначение, значение и разновидности процессов селективного гидрокрекинга? Дайте краткую характеристику технологии процессов гидродепарафинизации и селектоформинга.
320 Температура вспышки, воспламенения и самовоспламенения, назначение этих характеристик, методы определения.
321 Требования к реактивным топливам для двигателей со сверхзвуковой скоростью по фракционному и химическому составу, объяснить.
322 Схемы атмосферной перегонки нефти, преимущества и недостатки каждой.
Гальванические элементы и электродвижущая сила
Заказ текстовых ответов 100руб
Вопрос 10-1 Что называется стандартным потенциалом электрода по водородной шкале? С помощью какого гальванического элемента и при каких условиях можно эспериментально определить, этот потенциал с учетом его знака? Ответ проиллюстрируйте конкретным ответом
Скачать Вопрос 10-1 (физ химия)(24.09 Кб) скачиваний573 раз(а)
Вопрос 10-2 Приведите пример электрода первого рода. От каких факторов зависит потенциал этого электрода? Как можно увеличить значение данного потенциала? Запишите электродную реакцию и уравнение Нсрнста, назовите вес используемые величины.
Скачать Вопрос 10-2 (физ химия)(24.65 Кб) скачиваний519 раз(а)
Вопрос 10-3 Приведите пример электрода второго рода. От каких факторов зависит потенциал этого электрода? Как можно увеличить значение данного потенциала? Запишите электродную реакцию и уравнение Нернста, назовите все используемые величины.
Скачать Вопрос 10-3 (физ химия)(23.96 Кб) скачиваний512 раз(а)
Вопрос 10-4 Приведите пример газового электрода. От каких факторов зависит потенциал этого электрода? Как можно увеличить значение данного потенциала? Запишите электродную реакцию и уравнение Нернста, назовите все используемые величины.
Скачать Вопрос 10-4 (физ химия)(15.84 Кб) скачиваний469 раз(а)
Вопрос 10-5 Приведите пример окислительно-восстановительного электрода. От каких факторов зависит потенциал этого электрода? Как молшо увеличить значение данного потенциала? Запишите электродную реакцию и уравнение Нернста, назовите все используемые величины.
Скачать Вопрос 10-5 (физ химия)(14.84 Кб) скачиваний496 раз(а)
Вопрос 10-6 Как связан электродный потенциал газового электрода с парциальным давлением соответствующего газа в приэлектр одном пространстве? Приведите примеры электродов, потенциалы которых увеличиваются или уменьшаются при росте давления. Запишите соответствующие электродные реакции. Ответ обоснуйте анализом требуемых уравнений, называя все используемые величины.
Скачать Вопрос 10-6 (физ химия)(20.73 Кб) скачиваний473 раз(а)
Вопрос 10-7 Приведите пример химического гальванического элемента, составленного из электродов первого и второго рода, электрохимическая цепь нормально разомкнутая без жидкостных соединений - «без переноса». Запишите уравнения электродных полуреакций и уравнение химической реакции, самопроизвольно протекающей при включении данного гальванического элемента во внешнюю цепь. Вычислите ЭДС данного элемента в стандартных условиях при температуре 25°С.
Скачать Вопрос 10-7 (физ химия)(31.84 Кб) скачиваний615 раз(а)
Вопрос 10-8 Прмисдиге пример химического гальванического элемента, составленного из электрода первого рода и газового электрода, электрохимическая цепь, нормально разомкнутая с жидкостным соединением - «с переносом». Запишите урлкнения электродных полуреакций и уравнение химической реакции* самопроизвольно протекающей при включении данного " гальванического щсмснта во внешнюю цепь. Вычислите ЭДС данного элемента в стандартных условиях при температуре 25°С.
Скачать Вопрос 10-8 (физ химия)(30.91 Кб) скачиваний582 раз(а)
Вопрос 10-9 Приведите пример концентрационного гальванического элемента, составленного из двух электродов второго рода, электрохимическая цепь нормально разомкнутая с жидкостным соединением - «с переносом». Как определить полярность электродов данного элемента? Чем определяется величина ЭДС этого элемента? Напишите соответствующее уравнение и назовите входящие в него величины.
Скачать Вопрос 10-9 (физ химия)(29.65 Кб) скачиваний537 раз(а)
Вопрос 10-10 .Приведите пример концентрационного гальванического элемента, составленного из двух электродов первого рода, Электрохимическая цепь нормально разомкнутая без жидкостных соединений - «без переноса». Как определить полярность электродов данного элемента? Чем определяется величина ЭДС этого элемента? Напишите соответствующее уравнение и назовите входящие в него величины.
Скачать Вопрос 10-10 (физ химия)(29.5 Кб) скачиваний496 раз(а)
Вопрос 10-11 Приведите пример концентрационного гальванического элемента, составленного из двух электродов первого рода, электрохимическая цепь нормально разомкнутая с жидкостным соединением - «с переносом». Как определить полярность электродов данного элемента? Чем определяется величина ЭДС этого элемента? Напишите соответствующее уравнение и назовите входящие в нет о величины.
Скачать Вопрос 10-11 (физ химия)(20.09 Кб) скачиваний469 раз(а)
Вопрос 10-12 Запишите уравнение, являющееся электрохимической формой уравнения Гиббса-Гельмгольца на примере произвольного гальванического элемента. Назовите все величины, входящие в это уравнение. Какие термодинамические данные могут быть получены с использованием этого уравнения? Запишите соответствующие расчетные формулы.
Скачать Вопрос 10-12 (физ химия)(20.99 Кб) скачиваний519 раз(а)
Вопрос 10-13 Гальванические элементы (электрохимические цепи) какого типа могут использоваться для определения констант равновесия химических реакций? Какие исходные данные для этого необходимы и как их можно получить? Проиллюстрируйте процедуру расчета любым известным вам примером, называя все используемые величины.
Скачать Вопрос 10-13 (физ химия)(23.15 Кб) скачиваний571 раз(а)
Вопрос 10-14 .Гальванические элементы (электрохимические цепи) какого типа могут использоваться для определения изменений термодинамических функций в химических реакциях? Какие исходные данные для этого необходимы и как их можно получить? Проиллюстрируйте процедуру расчета на примере изменения энтальпии, называя все используемые величины.
Скачать Вопрос 10-14 (физ химия)(22.6 Кб) скачиваний461 раз(а)
Вопрос 10-15 Как по результатам измерений ЭДС гальванического элемента можно определить тепловой эффект химической реакции, протекающей в нем. Какие исходные данные для этого необходимы? Поясните процедуру расчета на конкретном примере.
Скачать Вопрос 10-15 (физ химия)(20.68 Кб) скачиваний515 раз(а)
Вопрос 10-16 Гальванические элементы (электрохимические цепи) какого типа могут использоваться для определения изменений термодинамических функций в химических реакциях? Какие исходные данные для этого необходимы и как их можно получить? Проиллюстрируйте процедуру расчета на примере изменения энтропии, называя все используемые величины.
Скачать Вопрос 10-16 (физ химия)(46.32 Кб) скачиваний508 раз(а)
Вопрос 10-17 Определить рН раствора. Запишите уравнения Нсрнста для электродов и всей гальванической цепи, образованной с их участием, назовите все используемые величины.
Скачать Вопрос 10-17 (физ химия)(20.45 Кб) скачиваний467 раз(а)
Вопрос 10-18 Предложите гальванический элемент, с помощью которого возможно определить полную активность хлорида иинка 2пС12 в водном растворе. Запишите уравнения электродных полурсакций и уравнение самопроизвольной химической реакции для данного гальванического элемента. Выведше выражение для активности, назовите все входящие в него величины.
Скачать Вопрос 10-18 (физ химия)(27.65 Кб) скачиваний568 раз(а)
Вопрос 10-19 Предложите гальванический элемент, с помощью которого возможно определить средний ионный коэффициент активности сульфата меди Си8О4 в водном растворе. Запишите уравнения электродных полуреакций и уравнение самопроизвольной химической реакции. Выведите выражение для коэффициента активности, назовите все входящие в него величины.
Скачать Вопрос 10-19 (физ химия)(28.02 Кб) скачиваний550 раз(а)
Вопрос 10-20 Приведите схему гальванического элемента, с помощью которого можно экспериментально определить термодинамическую константу равновесия реакции: Zn + Сu2+(ад) = Zn2+(ад) + Cu. Подтвердите ваше предложение выводом уравнения самопроизвольной химической реакции. Запишите выражение для
Скачать Вопрос 10-20 (физ химия)(21.65 Кб) скачиваний494 раз(а)
Вопрос 10-21 Предложите гальванический элемент, с помощью которого можно определить произведение растворимости иодата серебра AgIO3. Запишите уравнения электродных полуреакцнй и уравнение химической реакции, самопроизвольно протекающей в элементе. Выведите выражение для произведения растворимости.
Скачать Вопрос 10-21 (физ химия)(29.5 Кб) скачиваний527 раз(а)
Вопрос 10-22 Составьте гальванический элемент, с помощью которого возможно определить парциальное давление водорода в азот-водородной газовой смеси. Запишите уравнение, которое связывает ЭДС гальванического элемента с парциальным давлением водорода в анализируемой газовой смеси, назовите все входящие в нее о величины.
Скачать Вопрос 10-22 (физ химия)(28.36 Кб) скачиваний550 раз(а)
Cтраница 1 из 5


