Разработка математической модели кинетической реакции
Проводим разработку кинетической модели реакции, пример разработки
Возможно проведения исследования кинетики реакции по вашим данным!
Пример разобранной реакции
1 Исходные данные и подбор реакции
Исходные данные
Начальные концентрации:
• СА,0=0,5 моль/л = 500 моль/м3;
Значения констант скоростей при Т=580К:
• k1=0.2;
• k2=0.15;
Значения энергии активации:
• Е1=9,305*104 Дж/моль;
• Е2=10,1*104 Дж/моль;
Расход потока QV0=5590 л/ч = 0,00155 м3/с
Исходная схема:
 (1)
(1)
Для данной схемы были подобраны реакции термического разложения этанола
 (2)
(2)
Схема подобранных реакций
 (3)
(3)
Целевой компонент: этан (C2H6)
Кинетическая модель
На основании закона действующих масс составим уравнения для скорости реакции
По нашей модели по уравнениям (3) получим:

В Matlab вводим скорости реакций, константы химических реакций и начальные концентрации веществ.
x0 = [500 0 0]; % начальные концентрации веществ, моль/м3
t = [0 50];
[time,x]= ode45('kin',t,x0);
plot(time, x(:,1), time, x(:,2), time, x(:,3))
ylabel('концентрация, моль/м3');
xlabel('время, с');
legend ('Этанол','Этан','Кислород')
function y = kin(t,x)
k1 = 0.0002; % константа реакции второго порядка, 1/с
k2 = 0.00015; % константа реакции второго порядка, 1/с
r1 = k1*(x(1)^2);
r2 = k2*(x(2)^2)*x(3);
y = [r2-r1;r1-r2;r1-r2];
end
Время выбираем на промежутке от 0 до 50 секунд.
После ввода данных, имеем график зависимости концентрации веществ от времени:

Рис 2. График изменения концентраций веществ по времени.
Основная реакция по получению этана идет с разложением этанола [1]. Согласно анализу графика рис. 2 этан выделяется в максимальном количестве уже на первых секундах реакции до уровня 60 моль/м3. Для того, чтобы определить эффективность ректора идеального вытеснения с катализаторным комплексом необходимо составить график концентрации от длины реактора.
Гидродинамическая модель
Эта процесса представляет систему дифференциальных уравнений гидродинамики идеального вытеснения, записанную для каждого из компонентов реакционной смеси:

С позиций проектирования наиболее интересно исследование процесса при его стационарной реализации, то есть при:

Энергетическая модель
При исследовании работы реактора необходимо изучить особенности протекания реакций в широком диапазоне температур, то есть дополнить модель реактора частной энергетической моделью, учитывающей влияние температуры на константу скорости частной реакции в виде уравнения Аррениуса.
 (16)
(16)
где k – константа скорости реакции
v0 – предэкспоненциальный множитель
Еa – энергия активации, Дж/моль
R – универсальная газовая постоянная, Дж/моль×К
Т0 – начальная температура, К
При формировании полной модели с учетом энергетики процесса необходимо также учитывать зависимость скорости потока от температуры, связанную с изменением объема реакционной смеси.
В связи с тем, что все вещества являются газообразными в данных условиях, то используется следующая формула для скорости потока газа:
 (17)
(17)
w0- начальная скорость линейного потока, м/с
T- температура потока, К
w- линейная скорость потока, м/с
T0- начальная температура потока, К
Тепловой режим модели
Необходимо учитывать такой существенный фактор химического процесса, как теплота реакции, приводящая к разогреву или охлаждению реакционной смеси в реакторе.
Тепловые эффекты учитываются для рассматриваемой задачи частной тепловой моделью в форме дифференциального теплового баланса.
Реактор, в котором тепловые эффекты приводят к изменению температуры процесса и при этом отсутствует теплоперенос за пределы аппарата называется адиабатическим реактором.
Тепловая модель реактора описывается следующим уравнением:

Отсюда следует
 (18)
(18)
где υ - расход потока, м3/с
S- площадь поперечного сечения реактора, м3
ρ - плотность смеси, кг/м3
cp- Теплоемкость смеси, Дж/моль∙К
∆H1, ∆H2 – Энтальпии реакций, Дж/моль
Моделирование реактора
В качестве первого действия пересчитаем заданные при температуре 300 К константы скоростей реакций при действительных температурах протекания реакций (5-6) для создания энергетической модели реакций. Для этого в командном окне Матлаб вычислим соответствующие предэкспоненциальные коэффициенты по формуле
 (19)
(19)
где k0 – константа скорости при температуре Т0,
Еа – энергия активации (Дж/моль),
R – универсальная газовая постоянная (8,31 Дж/моль/К)

Результат расчета


Присвоим каждому компоненту системы порядковый номер для обозначения в расчетах:
• этанол – 1
• этан – 2
• кислород – 3
Таблица 1 - значения коэффициентов a, b и c для пересчета теплоемкостей компонентов реакционной смеси, а также формулы для расчета теплоемкостей веществ при определенной температуре.
 (20,21)
(20,21)
где a, b, c – константы пересчета теплоемкости при температуре Т (К), отличной от нормальных условий.
Таблица 1
Значения энтальпий веществ и коэффициентов a, b и с
|
Компонент |
ΔH0298, кДж/моль |
a |
b*103 |
c*10-6 |
|
Этанол |
-276,98 |
10,99 |
204,7 |
-74,2 |
|
Этан |
-84,67 |
5,75 |
175,11 |
-57,85 |
|
Кислород |
0 |
31,46 |
3,39 |
-3,77 |
Для создания тепловой модели системы реакций рассчитаем теплоемкость смеси (20-21), предварительно вычислив мольные доли каждого из компонентов системы как отношение концентраций соответствующих компонентов к сумме всех концентраций смеси по формуле
 (22)
(22)
где fi – мольные доли компонентов,
xi – концентрации компонентов, моль/м3.
 (23)
(23)
Cp – теплоемкость смеси, Дж/К,
cpi– теплоемкости компонентов, Дж/К.
В качестве следующего действия запишем уравнения для расчета энтальпии каждого из веществ, значения энтальпий и коэффициентов представлены в таблице 1.
 (24)
(24)
 - энтальпия компонентов при температуре Т(К),
- энтальпия компонентов при температуре Т(К),
 – энтальпии компонентов при нормальных условиях,
– энтальпии компонентов при нормальных условиях,
 – теплоемкости компонентов, Дж/К.
– теплоемкости компонентов, Дж/К.

Подставим полученные значения теплоемкостей, а также значения энтальпий при 298 К – ΔH0298 в уравнения расчета энтальпии каждого из веществ, затем при помощи полученных значений вычислим суммарную энтальпию каждой реакции как разность энтальпий продуктов и реагентов
Проведем выбор аппарата по адиабатным условиям



Рис. 3 График для адиабатных условий
При выполнении процесса при адиабатных условиях для реактора типа РИВ рис. 3, оптимальная температура процесса проведения реакции падает до 300К резко, что говорит о поглощении тепла реакцией в большом количестве в начальный момент времени. Процесс не стабилен, так как температура устанавливается только на длине 0,3 м, при этом максимальный выход этана остается на максимальном уровне 60 моль/м3.
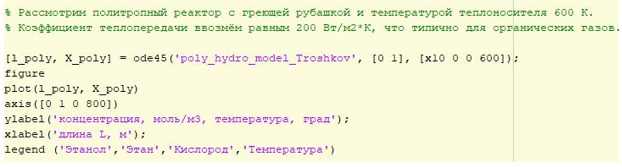
Проведем выбор аппарата по политропным условиям
Рассмотрим политропный реактор с греющей рубашкой и температурой теплоносителя 600 К.
Коэффициент теплопередачи возьмём равным 200 Вт/м2*К, что типично для органических газов.
Уравнение теплового баланса для политропного режима
 (25)
(25)
K - коэффициент теплопередачи в реакторе Вт/м2 К.
Th - температура внешнего теплоносителя, К.


Рис. 4 График для политропных условий
При выполнении процесса при политропных условиях рис. 4, видно, что температура за счет дополнительного подогрева увеличилась до 390 К при этом реакции осуществима мгновенно, минимальная эффективная длина реактора составляет 0,1м, выход этана максимальный и соответствует кинетической модели анализа.
Вывод: в результате проведения тепловых параметров процесса оптимальным является политропный режим, так как при адиабатном не достигается стационарность процесса из-за поглощения теплоты реакцией.
Выводы
На основании исходных данных по схеме реакции подобраны целевые реакции разложение этанола до этана. Произведен выбор аппарата идеального вытеснения РИВ и на основе действующего производства выбрана и описана кинетическая модель реактора.
По выбранным данным произведен расчет реактора в программе «MatLab» в результате составления программы получаем цилиндрический политропный реактор с подобранным диаметром d = 0,15м, длина реактора L = 0,1м. Выход целевого вещества этана 60 моль/м3.


