Задачи Игнатенков Бесков
Задачи из задачника Смирнова и Туболкина
Задачи из задачника Смирнова
Задача 1-4 (задачник Смирнов) Серная кислота взаимодействует с диэтилсульфатом
H2SO4 + (C2H5)2SO4 = 2C2H5SO4H
В начальный момент в объеме 100 см3 находится 58,3г H2SO4 и 92,0г C2H5SO4H. Концентрации этилсерной кислоты изменяется во времени следующим образом

Определить константы скорости прямой и обратной реакции и константы равновесия
Скачать решение задачи 1-4 (задачник Смирнов) (цена 200р)
Задача 2-5 (задачник Смирнов) Реакция A -(k1)-> R -(k2)-> S проводится в реакторе идеального смешения с рециклом
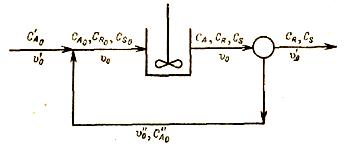
Константы скорости реакции k1=3,7*10-3, k2 = 2,4*10-3 c-1. Объем реактора V=1 м3. Исходная концентрация вещества А CA0 = 0,5 кмоль*м3. Производительность системы по исходному веществу G'A0 =1,25*10-3 кмоль с-1. Концентрация продуктов в исходной смеси СR0 = CS0 = 0 Сепаратор полностью отделяет продукт от непрореагировавшего вещества А, причем концентрация непрореагировавшего вещества А после реактора равна концентрации в рецикле. Система работает таким образом, что достигается максимальная концентрация продукта R.
Определить: 1) отношение объемной скорости рецикла к общей скорости подачи; 2) производительность системы по продукту; 3) концентрацию вещества А в растворе, подаваемом в реактор.
Скачать решение задачи 2-5 (задачник Смирнов) (цена 200р)
Задача 2-13 (задачник Смирнов) Реакция А -> 2R, имеющая константу скорости по веществу А, равную k = 4•10-3 с-1, проходит в реакторе идеального смешения при скорости подачи v0=2*10-3 м3*с-1 и начальной концентрации СА0=2,8*10-2 кмоль*м-3; СR0=0. Объем реактора V=0,5 м3. В результате прямоугольного импульса, который длится 100 с, концентрация исходного вещества увеличивается до СА01=6*10-2 кмоль*м-3.
Определить концентрацию продукта на выходе через 120 с после окончания импульса при условии, что концентрация вещества R в начальный момент времени равна нулю. Плотность реакционной смеси постоянна.
Скачать решение задачи 2-13 (задачник Смирнов) (цена 200р)
Задача 3-21 (задачник Смирнов) Для реакции второго порядка
A + B -(k1)-> R
R + B -(k2)-> S
Константы скорости k1 = k2. Концентрации исходных веществ соизмеримы, а константы продуктов реакции в начальный момент времени равны нулю CR0 = CS0 = 0.
Считая, что основным продуктом является вещество R , сравнить его максимальный выход, получаемый в реакторах идеального вытеснения и идеального смешения.
Скачать решение задачи 3-21 (задачник Смирнов) (цена 200р)
Задача 4-5 (задачник Смирнов) На основании опытов с трассером, проведенных для реального реактора, получены следующие данные:
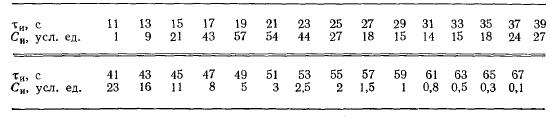
В реакторе проводится обратимая реакция A <-> R. Константы скорости: прямой реакции k = 4,2*10-1 с-1; обратной реакции k'= 6*10-3 с-1. Начальная концентрация СR0 = 0. Скорость подачи вещества А такая же, как и скорость подачи в опытах с трассером.
Сравнить по степени превращения четыре модели, которые предлагаются для описания реального реактора (рис. 4-12): 1) a1=v1/v2 = 0,625, Q = 0,68; 2) a2=v1/v2 = 0,625; Q =0,73; 3)a3=v1/v2 = 0,656; Q = 0,73; 4) a4=v1/v2 =0,656; Q = 0,78.
Для модели, которая лучше описывает реальный реактор, рассчитать степень превращения при соотношении концентраций CR/CA0 = 0,2 (остальные условия прежние).
Скачать решение задачи 4-5 (задачник Смирнов) (цена 200р)
Задача 4-12 (задачник Смирнов) В реальном реакторе проводится жидкофазная необратимая реакция первого порядка, протекающая с уменьшением плотности реакционной смеси в 1,08 раза при хА=1. Константа скорости реакции k=8*10-2 с-1.
Определить степень превращения вещества на выходе из реактора с учетом и без учета изменения плотности реакционной системы, если опыты с трассером дали следующие результаты:
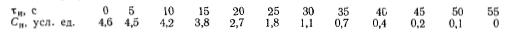
Считать, что при проведении реакции и в опытах с трассером действительное время пребывания одинаково.
Скачать решение задачи 4-12 (задачник Смирнов) (цена 200р)
Задача 5-15 (задачник Смирнов). В непрерывнодействующем реакторе идеального смешения проходит эндотермическая реакция первого порядка А <-> В. Тепловой эффект реакции H293 = 28 500 кДж(кмоль А)-1, изменение энергии Гиббса G = 1970 кДж (кмоль)-1, константа скорости k1= 8,19*104ехр(- 41100/RT) с-1. Начальные концентрации веществ: СА0 = 2,40 кмоль*м-3; СВ0 = 0; CR0 = 9,02 кмоль м-3(R - инертное вещество). Теплоемкости веществ срА = срВ=89 кДж (кмоль К)-1, ср=75 кДж (кмоль*К) не зависят от температуры. Температура исходной смеси t0 = 73 С.
Определить максимальную степень превращения и температуру, при которой можно ее достигнуть, если объем реактора равен V = 0,20 м3, а тепловые потери (в кВт) составляют Qпот = 0,020(t -tвозд).Принять tвозд =10 С.
Скачать решение задачи 5-15 (задачник Смирнов) (цена 200р)
Задачи из задачника Туболкина
Задача 3 (задачник Туболкин) Определить равновесный выход аммиака при синтезе его из точно стехиометрической азотоводородной смеси при t = 580 °C и P = 30 МПа. Температурная зависимость константы равновесия:
![]()
Скачать решение задачи 3 (Туболкин) (цена 150р)
Задача 5 (задачник Туболкин) Скорость реакции А + В -> D описывается уравнением первого порядка по каждому компоненту. Через 20 мин прореагировало 20 % вещества А. Какая часть вещества А останется через 40 мин?
Скачать решение задачи 5 (Туболкин) (цена 150р)
Задача 6 (задачник Туболкин) Определить объемы реакторов идеального вытеснения и полного смешения для реакции окисления SO2 в SO3 на ванадиевом катализаторе для степеней превращения по следующим данным.Процесс протекает при постоянной температуре (569 °C). Скорость реакции описывается уравнением Г. К. Борескова:
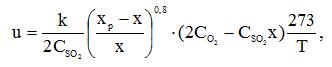
где CSO2, CO2 – начальные концентрации SO2 и О2 в газе, % (об.).
Расход газа 10000 м3/ч. Состав исходного газа [% (об.)]: SO2 – 9; О2 – 10; N2 – 81. Константа скорости реакции окисления SO2 в SO3 при 569 °C равна 11 c-1 равновесный выход Xp = 0,79.
Скачать решение задачи 6 (Туболкин) (цена 150р)
Задача 7 (задачник Туболкин) Определить объемную скорость газа в реакторе окисления SO2, если линейная скорость газа w = 0,8 м/с. Диаметр реактора D = 3 м. Высота слоя катализатора Температура в реакторе 500 °C.
Скачать решение задачи 7 (Туболкин) (цена 150р)
Задача 9 (задачник Туболкин) Найти коэффициент массопередачи в насадочном скруббере для поглощения ацетона из воздуха водой, расход которой составляет 4000 кг/ч. Смесь воздуха с парами ацетона содержит 5 % (об.) ацетона, причем расход чистого воздуха 2000 м3/ч. Степень поглощения ацетона при 20 °C достигает 98,2 %. Абсорбционная башня заполнена керамическими кольцами размером 25х25х3 мм, слой которых имеет высоту 18 м. Скорость газа в полном сечении башни принять на 20 % меньше скорости, соответствующей началу эмульгирования.
Скачать решение задачи 9 (Туболкин) (цена 150р)
Задача 10 (задачник Туболкин) Подсчитать массу водорода, выделившегося при электролизе разбавленного раствора Н2SO4, если через электролит пропущено 7,5 А·ч электричества.
Скачать решение задачи 10 (Туболкин) (цена 150р)
Задачи Мухленов разные
Задача М-9
Составить материальный баланс печи для сжигания серы производительностью 86,4 т/сутки. Степень окисления серы 0,88 (остальная сера возгоняется и сгорает вне печи). Коэффициент избытка воздуха a = 1,12. Расчет следует вести на производительность печи по сжигаемой сере в кг/ч.
Процесс горения серы описывается уравнением S + O2 = SO2
Скачать решение задачи М-9 (цена 100р)
Задача М-9-1
Составить материальный баланс печи для сжигания серы производительностью 59,5 т/сутки. Степень окисления серы 0,92 (остальная сера возгоняется и сгорает вне печи). Коэффициент избытка воздуха a = 1,55. Расчет следует вести на производительность печи по сжигаемой сере в кг/ч.
Процесс горения серы описывается уравнением S + O2 = SO2
Скачать решение задачи М-9-1 (цена 100р)
Задача М-9-2 (Вариант 10)
Составить материальный баланс печи для сжигания серы производительностью 55 т/сутки. Степень окисления серы 0,75 (остальная сера возгоняется и сгорает вне печи). Коэффициент избытка воздуха ? = 1,7. Расчет следует вести на производительность печи по сжигаемой сере в кг/ч.
Производительность 55 т/сут. Степень окисления S = 0,75 Коэффициент избытка воздуха, a = 1,7 Процесс горения серы описывается уравнением S + O2 = SO2
Скачать решение задачи М-9-2 (цена 100р)
Задача М-10
Составить материальный баланс производства окиси этилена прямым каталитическим окислением этилена воздухом. Состав исходной газовой смеси в %(об): этилен – 8,1, воздух – 91,9. Степень окисления этилена Х = 0,54. Расчет вести на 1 т оксида этилена. Уравнение реакции: 2СН2 = СН2 + О2 = 2(СН2)2О
Скачать решение задачи М-10 (цена 100р)
Задача М-10-1
Составить материальный баланс производства окиси этилена прямым каталитическим окислением этилена воздухом. Состав исходной газовой смеси в %(об): этилен – 7,5, воздух – 92,5. Степень окисления этилена Х = 0,54. Расчет вести на 1 т оксида этилена.
Скачать решение задачи М-10-1 (цена 100р)
Задача М-11
При электрокрекинге природного газа состава (объемные %): CH4 - 97, N2 - 3, в газе выходящем из аппарата, содержится 20% ацетилена. Рассчитать материальный баланс процесса на 1000м3 исходного газа без учета побочных реакций. Процесс можно отразить уравнением:
2CH4 = C2H2 + 3H2
Скачать решение задачи М-11 (цена 100р)
Задача М-12
Рассчитать материальный баланс печи окислительного обжига в производстве ванадата натрия NaVO3 в расчете на 1т готового продукта. Сырье: ванадиевый шлак, содержащий 13,3 %(масс.) V2O5 и воздух (расход NaCl составляет 8,0 %(масс.) от массы шлака).
2NaCl + 0,5O2 = Na2O + Cl2
Na2O + V2O5 = 2NaVO3
Скачать решение задачи М-12 (цена 100р)
Задача М-12-1
Рассчитать материальный баланс печи окислительного обжига в производстве ванадата натрия NaVO3 в расчете на 1т готового продукта. Сырье: ванадиевый шлак, содержащий 15,3 %(масс.) V2O5, воздух, NaCl. Расход NaCl составляет 11 %(масс.) от массы шлака.
2NaCl + 0,5O2 = Na2O + Cl2
Na2O + V2O5 = 2NaVO3
Скачать решение задачи М-12-1 (цена 100р)
Задача М-12-2
Рассчитать материальный баланс печи окислительного обжига в производстве ванадата натрия NaVO3 в расчете на 1т готового продукта. Сырье: ванадиевый шлак, содержащий 14,6 %(масс.) V2O5, воздух, NaCl. Расход NaCl составляет 7,0 %(масс.) от массы шлака
2NaCl + 0,5O2 = Na2O + Cl2
Na2O + V2O5 = 2NaVO3
Скачать решение задачи М-12-2 (цена 100р)
Задача М-13
Составить материальный баланс производства криолита (на 1т), если процесс описывается следующим суммарным уравнением:
2Al(OH) 3 + 12HF + 3Na2 CO3 = 2Na3AlF6 + 3CO2 + 9H2O.
Плавиковая кислота применяется в виде 19% раствора фтористого водорода в воде. Соду берут с 4,55% недостачи от стехиометрического соотношения для обеспечения необходимой остаточной кислотности.
Скачать решение задачи М-13 (цена 100р)
Задача М-13-1
Составить материальный баланс производства криолита (на 1т), если процесс описывается следующим суммарным уравнением:
2Al(OH)3 + 12HF + 3Na2 CO3 = 2Na3AlF6 + 3CO2 + 9H2O.
Плавиковая кислота применяется в виде 15,3% раствора фтористого водорода в воде. Соду берут с 4,5% недостачи от стехиометрического соотношения для обеспечения необходимой остаточной кислотности.
Скачать решение задачи М-13-1 (цена 100р)
Задача М-14
Составить материальный баланс хлоратора в производстве хлорбензола (1 т хлорбензола), если состав жидких продуктов в %(масс.) следующий: бензола - 65,0; хлорбензола – 28,0; дихлорбензола – 4,8; трихлорбензола – 2,2. Технический бензол содержит 98 %(масс.) С6Н6. Технический хлор – 93,5 %(масс.) Сl2.
Скачать решение задачи М-14 (цена 100р)
Задача М-14-1
Составить материальный баланс хлоратора в производстве хлорбензола (1 т хлорбензола), если состав жидких продуктов в %(масс.) следующий: бензола - 68,0; хлорбензола – 27,0; дихлорбензола – 2,8; трихлорбензола – 2,2. Технический бензол содержит 95,0 %(масс.) С6Н6. Технический хлор – 92,5 %(масс.) Сl2.
Скачать решение задачи М-14-1 (цена 100р)
Задача М-15
Рассчитать материальный баланс производства фтористого водорода на 1т НF из плавикового шпата, содержащего 90%(масс.) СаF2 и 10%(масс.) SiO2. Степень разложения шпата X=0,88. Для разложения применяется 92,6%-ная H2SO4 с 10,5%-ным избытком от теоретического.
Скачать решение задачи М-15 (цена 100р)
Задача М-15-1
Рассчитать материальный баланс производства фтористого водорода на 1т НF из плавикового шпата, содержащего 93,5%(масс.) СаF2 и 6,5%(масс.) SiO2. Степень разложения шпата X=0,8. Для разложения применяется 90,6%-ная H2SО4 с 11,5%-ным избытком от теоретического
Скачать решение задачи М-15-1 (цена 100р)
Задачи Мухленов
Задача 1-2 Определить расход технического карбида кальция, содержащего 85% CaCl2, для получения 1000л ацетилена, если степень разложения карбида кальция составляет 0,92.
Скачать решение задачи 1-2 (Мухленов) (цена 200р)
Задача 1-6 При термоокислительном крекинге метана (с целью получения ацетилена) смесь газов имеет состав [% (об.)]: C2H2 - 8,5; Н2 - 57,0; СО - 25,3; СО2 - 3,7; С2Н4 - 0,5; СН4 - 4,0; Аr - 1,0. Определить количество метана, которое нужно подвергнуть крекингу, чтобы из отходов крекинга после отделения ацетилена получить 1 т метанола: СО + 2Н2 = СН3ОН. По практическим данным из 1 т исходного метана получается после выделения С2Н2 1160 кг смеси газов.
Скачать решение задачи 1-6 (Мухленов) (цена 200р)
Задача 1-7 Сколько потребуется сульфата железа FeSO4*7H2O и хромого ангидрида CrO3 для получения 1 т железохромового катализатора конверсии оксида углерода, имеющего состав (%): Fe2O3 - 90, Cr2O3 - 10
Скачать решение задачи 1-7 (Мухленов) (цена 200р)
Задача 1-9 Рассчитать расход сульфата натрия (содержание Na2SO4 в техническом сульфате натрия 95% мас.) и электролитического водорода (содержание водорода в сырье 97% об.) для получения одной тонны технического сульфида натрия (содержание Na2S 96% мас.). На побочные реакции расходуется 2 %мас. Na2SO4 и водорода от теоретически необходимого количества для получения 1 тонны технического продукта.
Процесс можно описать уравнением реакции:
Na2SO4 + 4H2 = Na2S + 4H2O
Скачать решение задачи 1-9 (Мухленов) (цена 200р)
Задача 1-10. Рассчитать объем 65%-ной серной кислоты (плотностью 1,56г/л) с 5% избытком от теоретического количества, требуемый для разложения 100кг апатитового концентрата (содержащего 38% P2O5) по реакции:
2Ca5F(PO4)3 + 7H2SO4 = 3Ca(H2PO4)2 + 7CaSO4 + 2HF
Скачать решение задачи 1-10 (Мухленов) (цена 200р)
Задача 1-18 Составить материальный баланс нейтрализатора для получения аммиачной селитры производительностью 20 т NH4NO3 в час. В производстве применяется 47% - ная азотная кислота и 100% - ный газообразный аммиак по реакции:
HNO3 + NH3 = NH4NO3
Потери HNO3 и NH3 в производстве составляют 1% от теоретически необходимого количества для обеспечения заданной производительности. Из нейтрализатора аммиачная селитра выходит в виде 60%-го раствора NH4NO3 в воде. Определить количество влаги, испарившейся в результате экзотермической реакции нейтрализации.
Скачать решение задачи 1-18 (Мухленов) (цена 200р)
Задача 2-10 Определить равновесный состав газа (в Па) при синтезе метанола при соотношении H2/CO = 4,5 (в циркуляционном газе) содержание инертных примесей CИН = 13,8. Давление P = 300*105 Па (300атм), температура 365 . Температурная зависимость константы равновесия Кр = Р(СН3ОН)/Р(СО)/Р2Н2
Скачать решение задачи 2-10 (Мухленов) (цена 200р)
Задача 3-2 Подсчитать теоретическую температуру горения пропана при избытке воздуха 20% ( ). Реакция горения пропана:
С3Н8 + 5О2 = 3СО2 + 4Н2О + Q
Скачать решение задачи 3-2 (Мухленов) (цена 200р)
Раздел 1 и 2. Основные показатели химического производства и закономерности химических процессов
Задача 1-1 Химический состав оконного (силикатного) стекла выражается формулой Na2O*CaO*6SiO2, т.е. оно состоит из соды Na2O, известняка CaO и песка SiO2. Рассчитать теоретические коэффициенты по сырью при производстве стекла, если сода содержит 93,8% Na2CO3, известняк – 90,5% CaCO3 и песок – 99,0% SiO2.
Скачать решение задачи 1-1 (В.И. Игнатенков, В.С Бесков) (цена 150р)
Задача 1-2. Сколько потребуется сульфата железа FeSO4*7H2O и хромого ангидрида CrO3 для получения 1 т железохромого катализатора конверсии окиси углерода, имеющего состав: 90% - Fe2O3 и 10% - Cr2O3?
Скачать решение задачи 1.2 (В.И. Игнатенков, В.С Бесков) (цена 150р)
Задача 1-3 Негашенная известь содержит 94%, 12% и 4,8% примесей. Получается она обжигом известняка, содержащего 89% в негашенной извести получается из-за наличия в ней карбонатов еоличество которых определяет степень обжига известняка. определить расходный коэффициент известняка на 1 т извести указанного состава и степень обжига известняка.
Скачать решение задачи 1.3 (В.И. Игнатенков, В.С Бесков) (цена 150р)
Задача 1-4 Рассчитать расход колчедана, содержащего 40% S на 1 т H2SO4, если потери S и сернистого ангидрида в производстве серной кислоты составляют 3%, а степень абсорбции - 99%.
Скачать решение задачи 1-4 (В.И. Игнатенков, В.С Бесков) (цена 150р)
Задача 1-5 Рассчитать зависимость содержания кислорода в газах обжига от концентрации SO2 при воздушном дутье:
в) для обжига сернистого цинка ZnS.
Скачать решение задачи 1.5 (В.И. Игнатенков, В.С Бесков) (цена 150р)
Задача 1-7 Рассчитать расход бензола и пропан-пропиленовой фракции газов крекинга [30% (об.) пропилена и 70% (об.) пропана] для производства 1 т фенола, если выход изопропилбензола из бензола составляет 90% от теоретического, а фенола из изопропилбензола - 93%.
Молекулярная масса: бензола - 78, пропилена - 42, пропана - 44, фенола - 94.
Скачать решение задачи 1.7 (В.И. Игнатенков, В.С Бесков) (цена 150р)
Задача 1-8. Рассчитать расходные коэффициенты в производстве технического карбида кальция CaO + 3C = CaC2 + CO. Технический карбид кальция имеет следующий состав: 78 % СаС2, 15 % СаО, 3 % С, прочие примеси – 4 %. Известь содержит 96,5 % СаО. В коксе содержится 4% золы, 4 % летучих, 3% влаги. Молекулярные массы СаС2 – 64, СаО – 56.
Скачать решение задачи 1.8 (В.И. Игнатенков, В.С Бесков) (цена 150р)
Задача 1-9. Рассчитать основные технологические показатели производства бензола методом парофазовой дегидрогенизации циклогексана:
• теоретические и фактические расходные коэффициенты;
• выходы продуктов на подаваемый и превращенный циклогексан;
• общую и избирательную конверсии циклогексана.
Химическая схема процесса
C6H12 = C6H6 + 3H2
C6H12 = CH3C5H9
Материальный баланс производства метилциклопентана сведен в таблицу 1.
Таблица 1 – Материальный баланс получения бензола
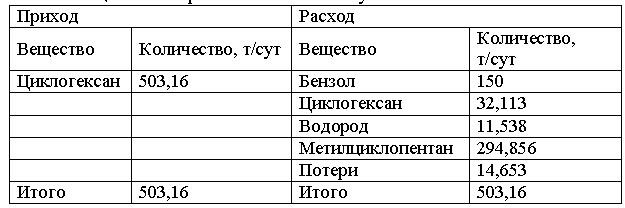
Скачать решение задачи 1.9 (В.И. Игнатенков, В.С Бесков) (цена 150р)
Задача 1-11 Рассчитать расходные коэффициенты по сырью в производстве 1 т фосфата аммония (NH4)3PO4. Фосфорная кислота имеет концентрацию 58%, а аммиак содержит 2% влаги.
Скачать решение задачи 1.11 (В.И. Игнатенков, В.С Бесков) (цена 150р)
Задача 1-12 Рассчитать теоретический и практический коэффициенты 97% изопентана в производстве 1 т изопрена. Процесс каталитического дегидрирования изопентана осуществляется по реакциям:
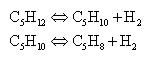
Выход изоамилена составляет 73%, а изопрена – 65% от теоретического.
Скачать решение задачи 1-12 (В.И. Игнатенков, В.С Бесков) (цена 150р)
Задача 2.1-1 Аккумуляторную кислоту (концентрация H2SO4 92,5%).нужно разбавить водой до содержания в ней 38% H2SO4. Сколько нужно взять воды для получения 180 кг разбавленной кислоты?
Скачать решение задачи 2.1-4 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-2 Сколько нужно взять купоросного масла (H2SO4 96%) и серной кислоты с концентрацией (H2SO4 64%), чтобы получить 2800кг 83%-ной H2SO4?
Скачать решение задачи 2.1-2 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-3 Сколько нужно взять растворов поваренной соли с концентрацией 310 и 230 г/л, чтобы получить 250 л раствора с концентрацией 280 г/л3
Скачать решение задачи 2.1-3 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-4 Азотную кислоту концентрацией 58% нужно разбавить водой до концентрации 46%. Сколько нужно взять воды, чтобы получить 2000кг разбавленной кислоты?
Скачать решение задачи 2.1-4 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-5. Влажность 150кг каменного угля при хранении на складе изменилась: а) с 8,4 до 3,9%; б) с 0,2 до 4%. Как изменилась масса угля?
Скачать решение задачи 2.1-5 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-6 Влажность 200кг серного колчедана при хранении на воздухе изменилась с 3 до 6% массовых долей. Как при этом изменилась масса колчедана?
Скачать решение задачи 2.1-6 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-7 Влажность 300кг извести при хранении изменилась с 2 до 5% массовых долей. Как при этом изменилась масса извести?
Скачать решение задачи 2.1-7 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-8. Определить расход бурого угля (70% массовых долей С), водяного пара и воздуха для получения 1000м генераторного газа, содержащего в объемных долях,%: СО-40, Н2 - 18, N2 - 42. Процесс газификации твердого топлива содержит две основные реакции:
C + H2O = CO + H2
2C + O2 = 2 CO
Скачать решение задачи 2.1-8 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-9 Определить расходные коэффициенты в производстве карбида кальция (технического), содержащего [% (масс.)]: CaC2 -85; CaO -5; C-3; прочие примеси- ост. Известь содержит 96,5% CaO. Содержание (%масс) в коксе: золы- 4, летучих - 4, влаги- 3.
Расчёт вести на 1 т технического продукта. Молекулярная масса: CaC2- 64, CaO- 56.
Скачать решение задачи 2.1-9 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-10 Рассчитать расходные коэффициенты при производстве 1 т фосфора разложением фосфоритного концентрата. Процесс описывается уравнением:
Ca3(PO4)2 + 5С + SiO2 = 3CaO*SiO2+2P+5CO
Концентрат содержит 25% массовых долей Р2О5, кокс - 94,5% массовых долей углерода, степень восстановления фосфора равна 0,85.
Скачать решение задачи 2.1-10 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-12 Рассчитать состав шихты в производстве глинозема из боксита, соды и известняка методом спекания. Исходный боксит содержит, массовые доли, %: Al2O3 - 50; SiO2 - 10; Fe2O3 - 20. Мольное отношение компонентов (модуль) в спеке: M1 = Na2O/(SiO2 + Fe2O3) = 1; M2 = CaO/SiO2 = 2. Известняк содержит 90 % массовых долей СаСО3, техническая сода - 96 % массовых долей Na2СO3. Расчет вести на 1000 кг боксита.
Скачать решение задачи 2.1-12 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-13 Определить расходный коэффициент по техническому карбиду кальция в производстве ацетилена. В техническом продукте содержится 83% CaC2, а степень превращения CaC2 в производстве равна 0,88.
CaC2 + 2H2 = Ca(OH)2 + C2H2
Скачать решение задачи 2.1-13 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-14. Определить расход бурого угля (70% масс. долей углерода), водяного пара и воздуха для получения 1000м генераторного газа, в состав которого входят %об: СО - 40, H2 - 18, N2 - 42.
Процесс газификации протекает по реакциям:
C + H2O = CO + H2
2C + O2 = 2CO
Скачать решение задачи 2.1-14 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-15 Составить материальный баланс процесса газификации 1 т кокса, идущей по реакциям
C + H2O = CO + H2 - 131 кДж
CO + H2O = CO2 + H2 + 42 кДж
В коксе содержится 3% массовых долей зольных примесей, массовое соотношение пар/кокс составляет 1,5, степень превращения углерода в коксе – 0,98, выход монооксида углерода – 0,90. Найти также общее количество подведенной теплоты.
Скачать решение задачи 2.1-15 (В.И. Игнатенков, В.С Бесков) (цена 150р)
Задача 2.1-16 Составить материальный баланс и рассчитать выход SO2 при обжиге 1000кг руды, содержащей 22% массовых долей серы в виде сульфида цинка (остальное –несгораемые примеси) и при подаче полуторакратного избытка воздуха по отношению к стехиометрии. Реакция обжига
2ZnS+3O2=2ZnO+2SO2
В огарке содержится 0,5% массовых долей серы.
Скачать решение задачи 2.1-16 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-17. При обжиге известняка образуется твердый продукт следующего состава:
CaO CO2 Балласт
Вариант 1 92 2,4 остальное
Вариант 2 94 1,2 остальное
В исходном сырье содердится CaCO3 масовые доли, %:
вариант 1 - 91;
вариант 2 - 89.
Определить расход известняка на 1 т целевого продукта в виде CaO и степень превращения CaCO3.
Скачать решение задачи 2.1-17 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-18 Обжиговый газ, состоящий из 8% объемных долей SО2 и 12% объемных долей О2, остальное азот, подвергнут окислению на катализаторе. Степень окисления SО2 - 88%. Рассчитать состав газа после окисления в процентах.
Скачать решение задачи 2.1-18 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-19 Воздух, подводимый к доменной печи, содержит, объёмные доли, %: O2 – 21,1; N2 – 77,3; водяных паров – 1,6. Сколько потребуется добавить к воздуху кислорода, чтобы его концентрация стала равной 25% объёмных долей?
Скачать решение задачи 2.1-19 (В.И. Игнатенков, В.С Бесков) (цена 150р)
Задача 2.1–21 Рассчитать конечный состав газовой смеси, если ее исходный состав в массовых долях, % (объемных долях, %): СН4 – 16,5 (20,7); С2Н6 – 9,7 (22,9); О2 – 44,9 (18,6); N2 – 28,9(37,8). Количество смеси – 1000 кг (1000 м3). Какой конечный состав смеси в объемных долях, % (массовых долях, %), если удалено: СН4 – 105 кг (150 м3); О2 – 300 м3 (150 кг); добавлено водяного пара – 200 м3 (100 кг)?
Скачать решение задачи 2.1-21 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-22. Определить соотношение между H2 и N2 в азотоводородной смеси на входе в реактор синтеза аммиака,если в газе на выходе из него содержится, объемные доли,%: NH3 - 17; N2 - 11; H2 - 72.
Скачать решение задачи 2.1-22 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-23 Определить производительность колонны синтеза аммиака объемом 4м, если нагрузка по газу на единицу объема реактора составляет 3000м/ч. равновесная степень превращения реагентов, взятых в стехиометрическом соотношении, составляет 0,26, а выход аммиака - 0,78.
Скачать решение задачи 2.1-23 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-24 В реакторе протекают реакции:
А+2В=R
R +В= S
А +В= 2Т
Начальные концентрации, кмоль/м3: СА0=2, СВ0=2,3, СR0=СS0=СТ0 =0. Объёмный расход реакционной смеси 5*10-2 м3/с; Выходные концентрации, кмоль/м3: СА=1,4, СR=0,2, СS=0,4.
Определить степени превращения вещества В по реакциям; производительность по продукту R.
Скачать решение задачи 2.1-24 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-25 В реакторе протекают жидко-фазные реакции:
А+В=R
А+А= S
2 S +В= Т+2D
R+А=Т
Определить производительность реактора по веществам R и S при следующих условиях:
СА0=2, СВ0=1,7, СА=0,1, СВ=0,5, СТ=0,15, СD=0,05 кмоль/м3; объёмный расход реакционной смеси 1*10-2 м3/с; СR0=СS0=СТ0=СD0=0.
Скачать решение задачи 2.1-25 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-26 В реакторе идеального смешения протекают реакции:
А+2В=R
R + В = S
3В= 2Т
2А+ В = S+В
Концентрация, кмоль/м3 СR0=СS0=СТ0=СD0=0, СА0=1, СR=0,05, СА=0,44, СS=0,33, СТ=0,14; Скорость подачи исходных веществ 5•10-3 м3/ч;. Определить производительность по исходному веществу В и по продукту D.
Скачать решение задачи 2.1-26 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-27 В реакторе в адиабатических условиях протекают реакции:
А+В=R+D
2B=P
2R=S
Начальные концентрации, кмоль/м3: СА0=0,1, СВ0=0,3, СR0=СD0=СP0=СS0=0. Выходные концентрации, кмоль/м3: СP=0,028, СS=0,012, СD=0,034. Тепловые эффекты реакций, кДж/кмоль: Qp1=1,1•105, Qp2=8,8•104, Qp3=4,7*104. Плотность реакционной смеси 860 кг/м3, её удельная теплоёмкость 2,85*10^3 Дж/(кг•град). Объёмный расход смеси 2,6*10-2 м3/с.
Определить производительность реактора по продукту R и температуру на выходе реактора, если начальная температура 12 С.
Скачать решение задачи 2.1-27 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-28 В реакторе в адиабатических условиях протекают реакции:
2А+В=R
R 2B= S
3В=2Т
Начальные концентрации, кмоль/м3: СА0=0,3, СВ0=0,2, СR0=СТ0= =СS0=0. Выходные концентрации, кмоль/м3: СВ=0,016, СS=0,011, СТ=0,03. Тепловые эффекты реакций, кДж/кмоль: Qp1=1,2•105, Qp2=6,8•104, Qp3=4,7•104. Плотность реакционной смеси 850 кг/м3, её удельная теплоёмкость 2,4•103 Дж/(кг•град). Объёмный расход смеси 3,4•10-2 м3/с.
Определить производительность реактора по продукту R и температуру на выходе реактора, если температура на входе 298 С.
Скачать решение задачи 2.1-28 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-29 Взаимодействие ацетилена с формальдегидом дает промежуточный –пропаргиловый спирт, а затем бутиндиол-1,4 по схеме
С2Н2 +СН2О => С3Н4О + СН2О => С4Н4О2
Степень превращения по ацетилену составляет 0,98, селективность по пропаргиловому спирту –0,66. Рассчитать необходимое количество ацетилена и формальдегида для получения 350 кг пропаргилового спирта в час.
Скачать решение задачи 2.1-29 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-30. Протекает обратимая реакция A + 2B = 2R + S. Начальные количества веществ, NA0 = 10, NB0 = 25, NR0 = 12 кмоль. В равновесной смеси NA = 2,5 кмоль.
Скачать решение задачи 2.1-30 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-31. Для реакции А+2В=2R, протекающей в жидкой фазе, определить степень превращения и соста реакционной смеси (CA, CB, CR) при xA = 0,45: 1) CA0 = 1; CB0 = 2; 2) CAO = 1, CBO = 1 кмоль/м3.
Скачать решение задачи 2.1-31 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-32 Определить состав реакционной смеси в конце процесса для реакции A + 3B = 2R, протекающей в жидкой фазе, если: 1) хА = 0,2; 2) хВ = 0,2; 3) СВ0 - 5 кмоль/м3.
Скачать решение задачи 2.1-32 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-33 Протекает реакция А=3R. Определить состав реакционной смеси на выходе из реактора, если САО = 1 кмоль/м3, хА = 0,5. Принять, что объем реакционной смеси не меняется.
Скачать решение задачи 2.1-33 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-34 В газовой фазе протекает реакция А+В=3R. Определить состав реакционной смеси в молярных долях, если
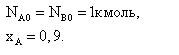
Скачать решение задачи 2.1-34 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-37 Для проведения реакции дегидратации этилового спирта
2С2Н5ОН = (С2Н5)2О + Н2О
взято исходное количество спирта, равное 24 моль, получено 8 моль эфира. Рассчитать состав полученной реакционной смеси, степень превращения реагента и выход продукта.
Скачать решение задачи 2.1-37 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-38 Для проведения реакции дегидратации этилового спирта
2С2Н5ОН = (С2Н5)2О + Н2О
взято исходное количество спирта, равное 24 моль, получено 8 моль эфира. Рассчитать состав полученной реакционной смеси, степень превращения реагента и выход продукта.
Скачать решение задачи 2.1-38 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-39 Протекают две параллельные реакции 2А=R и А=3S. Определить выход продукта R, степень превращения реагента А и селективность по продукту R, если на выходе из реактора известны количества веществ Na = 2моль, NR =NS = 3моль.
Скачать решение задачи 2.1-39 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-40 Протекают последовательные реакции А=2R и R=S. Определить степень превращения реагента А, выход и селективность по продукту R, если известен конечный состав реакционной смеси, кмоль/м3: CA = 1; CR = 2; CS = 2.
Скачать решение задачи 2.1-40 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-41 Определить выход продукта R и степень превращения реагента А, если обратимая реакция А-2R протекает до равновесия, когда xA=0,75 xA, равн, а соотношение концентраций продукта и реагента СR: СА=1.
Скачать решение задачи 2.1-41 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-43 Окисление аммика воздухом до образования оксида азота как целевого продукта протекает по следующим реакциям:
4NH3+5O2=4NO+6H2O
4NH3+3O2=2N2+6H2O
4NH3+4O2=2N2O+6H2O
Селективность по NO равна 0,92, степень окисления аммиака 0,98. Определить сколько дополнтельно образуется азота, если на процесс поступает аммиачно-воздушная смесь в количестве 1000 м3 при концентрации аммиака 9% объемных долей.
Скачать решение задачи 2.1-43 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-45 Для параллельной жидкофазной реакции первого порядка определить интегральную селективность и выход по продукту R, если начальная концентрация реагента А равна 1,42 кмоль/м3, общая степень превращения 0,89, а концентрация продукта R = 0,438 кмоль/м3.
Скачать решение задачи 2.1-45 (В.И. Игнатенков, В.С Бесков) (цена 150р)
Задача 2.1-46 Для последовательной реакции A → R → S определить интегральную селективность по продукту R, выход этого продукта и общую степень превращения реагента А, если после окончания реакции в смеси концентрации веществ составили, кмоль/м3: CA = 0,2, CR = 0,56, CS = 0,24
Скачать решение задачи 2.1-46 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2-1-47 При проведении двух последовательных реакций первого порядка гидратации ацетилена и дегидратации ацетальдегида из 1 моль ацетилена и 10 моль водяного пара получено 0,4 моль ацетальдегида и 0,025 моль кротонового альдегида. Рассчитать общую и частные степени превращения ацетилена (по обеим реакциям), состав полученной реакционной смеси, интегральную селективность по ацетальдегиду и выход ацетальдегида.
C2H2 + H2O → CH3CHO
2CH3CHO → CH3-CH=CH-CHO
Скачать решение задачи 2.1-47 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2-1-48. При проведении последовательной реакции дегидрирования
C4H10 → C4H8 → C4H6
частные степени превращения бутана в бутилен и бутадиен составляют соответственно 0,38 и 0,04. Рассчитать состав полученной реакционной смеси, общую степень превращения бутана, интегральную селективность и выход по бутилену, если исходное количество бутана 21 моль.
Скачать решение задачи 2.1-48 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-49 Получение фенола состоит из трех стадий:
C6H6 + CH2CHCH3 → C6H5CH(CH3)2) →
→ C6H5C(CH3)2OOH → C6H5OH + CCH3)2O
Рассчитать расход бензола и пропан-пропиленовой фракции газов крекинга (30% об. долей пропилена и 70% объемных долей пропана) для производства 1 т фенола, если выход изопропилбензола из бензола составляет 90%, фенола из изопропилбензола через стадию окисления изопропилбензола в гидропероксид -93%. Молекулярная масса бензола -78, пропилена - 42, пропана – 44, фенола-94.
Скачать решение задачи 2.1-49 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-50. Определить расход аммиака и воздуха на 1 т моногидрата HNO3, если степень окисления NH3 в NO равна 0,96, а степень абсорбции оксидов азота - 0,98. Расход воздуха учитывать только в реакциях окисления NH3 и NO.
Брутто-реакция: NH3 + 2O2 = HNO3 + H2O
Молекулярная масса: NH3 - 17; HNO3 - 63.
Скачать решение задачи 2.1-50 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-51. Рассчитать расход аммиака и воздуха на 1 т 50% азотной кислоты при степени окисления аммиака в оксид азота 0,95 и степени абсорбции оксидов азота 0,96. при расчете расхода воздуха учитывать только стехиометрию реакций по схеме NH3 -> NO -> NO2 -> HNO3
Скачать решение задачи 2.1-51 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-52 Рассчитать количество и состав газа, получаемого при окислении аммиачно-воздушной смеси, содержащей 6% массовых долей аммиака в воздухе. Степень окисления аммиака равна 0,97, выход оксида азота равен 95%. Считать, что аммиак окисляется до оксида азота и азота.
Скачать решение задачи 2.1-52 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-53 Нагрузка на реактор синтеза аммиака составляет 2000 м3/ч азотоводородной смеси стехиометрического состава, находящейся под давлением 2,5 МПа и температуре 700 К. Газ на выходе из реактора содержит 20 % объемных долей аммиака, тепловой эффект реакции - 112 кДж. Рассчитать состав газовой смеси на выходе из реактора и количество выделенной теплоты.
Скачать решение задачи 2.1-53 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-54 Определить количество аммиака, требуемое для производства 100 т/год 100 %-ной азотной кислоты, и расход воздуха на окисление аммиака, если цех работает 355 дней в году, выход оксида азота 0,97, степень абсорбции оксидов азота 0,92, содержание аммиака в сухой аммиачно-воздушной смеси 9,5 % объемных долей.
Скачать решение задачи 2.1-54 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-57 Конверсия метана водяным паром до оксида углерода и водорода сопровождается поглощением 206 кДж теплоты на стехиометрию реакции. В реактор поступает реакционная смесь в мольном соотношении пар/метан равном 3:1. Определить степени превращения метана и водяного пара, общее количество поглощенной теплоты при переработке 10 м3/с исходной смеси, если на выходе из реактора содержится 10 % объемных долей окиси углерода.
Скачать решение задачи 2.1-57 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-58 Определить количество теплоты, необходимое для получения водорода каталитической конверсией метана по реакции:
CH4 + H2O = CO + 3H2 - 206 кДж
Степень превращения метана равна 0,92, объемное отношение в исходной парогазовой смеси составляет 1:2,8. температура в зоне реакции -980 , температура поступающих в реактор реагентов - 130 . Потери теплоты в окружающую среду составляют 5% от поступающей. Расчет вести на 1000 м полученного водорода. Молярные теплоемкости газов, кДж/(кмоль град): СH4 = 36,8; H2O = 36; CO = 30,5; H2 = 29,5
Скачать решение задачи 2.1-58 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-59 Составить материальный баланс процесса паровой конверсии метана СН4 + Н20 = СО + ЗН2, если степень превращения СН4 равна 0,95, мольное отношение Н20/СН4 = 3. Расчет вести на 1000 и3 исходной парогазовой смеси.
Скачать решение задачи 2.1-59 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-60 Определить расход воздуха для дожигания 100м3 отходящих газов, состоящих, об.доли%:

Рассчитать состав газовой смеси после дожигания:
2CO + O2 = 2CO2
Скачать решение задачи 2.1-60 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-61 Определить расход сухого воздуха, количество и состав обжигового газа, количество и состав огарка при обжиге 1 т/ч флотационного колчедана, содержащего 38% массовых долей серы. В колчедане выгорает 96% серы. Коэффициент избытка воздуха составляет 1,4 по отношению к стехиометрии
FeS2 + 11O2 = 2Fe2O3 + 8SO3
Скачать решение задачи 2.1-61 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-62. Рассчитать выход и определить количество выделенной теплоты при обжиге 1000кг серного колчедана, содержащего 41% массовых долей серы при влажности 7,4%массовых долей. В огарке содержится 0,5%массовых долей серы. Реакция:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2 + 3415 кДж.
Скачать решение задачи 2.1-62 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-63 Рассчитать количество теплоты, выделяемой при переработке 1000 сернистого газа, состоящего из 10% объемных долей SО2 в воздухе. Степень превращения SО2 равна 90%. Каким будем при этом состав смеси на выходе из реактора (в об долях,%)? Реакция:
SО2 +0,5О2 → SО3+ 92000Дж.
Составить материальный баланс реактора окисления SО2 в SО3
При переработке 10000 /ч сернистого газа, содержащего 10% объемных долей в воздухе SО2 .
Скачать решение задачи 2.1-63 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-64 Оксид этилена получают окислением этилена по реакциям:
С2H4 + 0,5O2 = C2H4O + 117кДж
C2H4 + 3O2 = 2CO2 + 2H2O + 1217кДж.
Рассчитать объемный расход исходной смеси (8% объемных долей этилена, 19,32% объемных долей кислорода, остальное-азот). для получения 250м /ч оксида этилена, если селективность по нему составляет 0,65, а степень превращения этилена равна 0,98. Определить также общее количество выделившейся при этом теплоты.
Скачать решение задачи 2.1-64 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-65. Рассчитать материальный баланс производства хлора методом электролиза водного раствора NaCl
2NaCl + 2H2O = 2NaOH + Cl2 + H2
Концентрация NaCl в растворе 310г/л. Плотность раствора при условиях электролиза 1,17кг/л. Степень разложения NaCl - 50%. Расчет вести на 1000м хлора.
Скачать решение задачи 2.1-65 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-66 Составить материальный и тепловой балансы сжигания сероводорода для сернокислотного завода производительностью 25 т/ч моногидрата (100% H2SO4). Исходный газ содержит, объемные доли, %: H2S - 91; Н2О - 6; N2 - 3. Средняя его теплоемкость 1,68 кДж/(м3*град). На 1 м3 сероводородного газа в печь подается 23 м3 воздуха (в пересчете на сухой). Содержание влаги в воздухе - 8% объемных долей. Температура поступающего воздуха и сероводородного газа 33 °С. Производственные потери 20% массовых долей. Потери теплоты в окружающую среду 5%. Теплота сгорания H2S -519,3 кДж/моль, теплоемкости, кДж/(м3*град): SO2 - 1,47; воздуха -1,34. Определить также температуру выходящих газов.
Скачать решение задачи 2.1-66 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.1-69 Пиролиз бутана протекает по реакциям:
C4H10 - C3H6 + CH4
C4H10 = C2H4 + C2H6
Рассчитать степень превращения бутана, если в конечно смеси его концентрация составляет 0,1 молярной доли.
Скачать решение задачи 2.1-69 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Раздел 2.2 до 2-5
Задача 2.2-1 Вывести уравнение для расчета равновесной степени превращения реагента А по известной Кс для реакции 2A ↔ R.
Скачать решение задачи 2.2-1 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-2 Вывести уравнение для расчета равновесной степени превращения реагента А в газофазной реакции по известным значениям константы равновесия Кр и давления Р в системе для реакции А+В ↔ R.
Скачать решение задачи 2.2-2 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-3 Вывести уравнение для расчета равновесного состава компонентов реакции синтеза аммиака по известным значения константы равновесия Кр и давления Р в системе.
Скачать решение задачи 2.2-3 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-5 Найти константы равновесия при температурах 500 и 2000 К для реакции
Н2О + СО ↔ Н2O + СО2,
если G500 = -20,2 и G2000 = 25,3 кДж/моль
Скачать решение задачи 2.2-5 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-7 Рассчитать константу равновесия синтеза хлористого водорода из водорода и хлора, если равновесная степень превращения по хлору равна 0,65. Синтез проводится под давлением 3*105 Па. Реакционная смесь взята в стехиометрическом соотношении.
Скачать решение задачи 2.2-7 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-9 Рассчитать константу равновесия и равновесные концентрации реакции восстановления диоксида углерода на графите, если степень превращения диоксида углерода равна 0,96. Процесс проводится под атмосферным давлением.
Скачать решение задачи 2.2-9 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-11 Рассчитать константу равновесия при температуре 573 К, равновесную степень превращения ХрА и равновесный состав смеси для реакции:
А + В = 2R,
Если Н0573 = -24,5 кДж/моль S0573 = - 58 кДж/(кмоль•град), СА0 = 2 кмоль/м3, СВ0 = 2 моль/м3, СR0 = 0.
Скачать решение задачи 2.2-11 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-12 Определить равновесную степень превращения реагента А и производительность по продукту R для реакции 2А → R + S, протекающей в газовой фазе, если константа равновесия КС = 0,36, температура проведения реакции Т = 400 К, парциальное давление компонента в исходной смеси РА0 = 0,1 МПа, объемный расход через реактор 2 м3/с, выход по продукту ЕR = 0,9.
Скачать решение задачи 2.2-12 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-13 Определить константу равновесия, равновесную степень пре-вращения компонента А и состав равновесной реакционной смеси для реакции
A + 2B ↔ 3R,
если G373 = -11,2 кДж/моль, CA0 = 1 кмоль/м3, CB0 = 2 кмоль/м3, Т = 373 К
Скачать решение задачи 2.2-13 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-14 В газовой фазе протекает реакция А ↔ 2R. Вычислить равновесную степень превращения компонента А при давлении Р = 5 МПа, если Кp = 2,05 МПа-1.
Скачать решение задачи 2.2-14 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-15 Обратимая реакция A + B ↔ 2R протекает при температуре 298 К и характеризуется тепловым эффектом H298 = -30000 кДж/кмоль и изменением удельной энтропии S298 =-80 кДж/(кмоль-К). Определить, во сколько раз изменится равновесная степень превращения реагентов, если соотношение начальных концентраций реагентов СА0 : Сво изменится от 0,5 до 0,25.
Скачать решение задачи 2.2-15 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-16 Обратимая реакция A + B - R + S характеризуется следующими термодинамическими параметрами: ΔH3500 = -59500 кДж/кмоль, ΔS3500 = -175,5 кДж/кмоль*K. Определить состав равновесной реакционной смеси, если СА0 = СВ0 = 1,5*102 кмоль/м3, температура проведения процесса Т = 330 К.
Скачать решение задачи 2.2-16 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2-2-17. Обратимая реакция первого порядка A ↔ R характеризуетсяследующими термодинамическими параметрами: ΔH0 = -26000 кДж/кмоль, Kp298 = 17,5. Определить во сколько раз изменится значение равновесной степени превращения xpA, если температуру проведения процесса изменить с 298 до 348 К. Считать, что ΔH0 и ΔS0 не зависят от температуры.
Скачать решение задачи 2.2-17 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2-2-18. Для обратимой реакции 2A ↔ R + S ΔG2980 = -5620 кДж/кмоль. Определить равновесный состав смеси при температуре 298К, если CA0 = 0,2 кмоль/м3, CR0 = CS0 = 0.
Скачать решение задачи 2.2-18 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-19 Для обратимой реакции A + B ↔ R + S константы скорости прямой и обратной реакций, л/(моль•с), могут быть рассчитаны по уравнениям: k1 = 6,2•104exp(-27600/(RT), k2 = 7,5•105exp(-32000/(RT). Определить состав равновесной смеси, если СА0 = СВ0 = 2 кмоль/м3, Т = 500 К.
Скачать решение задачи 2.2-19 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2-2-20 Для реакции гидрирования бензола C6H6 + 3H2 ↔ C6H12, проводимой при начальном мольном соотношении реагентов H2 : C6H6 = 10 : 1, равновесная степень превращения бензола равна 0,95. Рассчитать состав равновесной смеси.
Скачать решение задачи 2.2-20 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-21 Рассчитать равновесную степень превращения оксида углерода хр в газофазной реакции CO + H2O ↔ H2 + CO2, протекающей при давлении 0,5 МПа. Исходные реагенты взяты в стехиометрическом соотношении. Константа равновесия реакции k = 8. Найти мольное отношение CO : H2O, необходимое для увеличения хр на 10%.
Скачать решение задачи 2.2-21 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-22 Рассчитать равновесное содержание фосгена, образующегося из оксида углерода и хлора по следующим данным:

Скачать решение задачи 2.2-22 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-23 Рассчитать равновесное содержание триоксида серы при окислении диоксида серы кислородом воздуха по следующим данным:
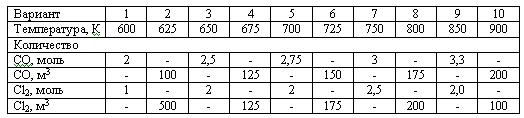
Температурная зависимость константы равновесия Кр, Па-0,5: lg(Kp) = 4905,5/T - 7,4119
Скачать решение задачи 2.2-23 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-24 Рассчитать равновесное содержание триоксида серы при окислении диоксида серы кислородом воздуха по следующим данным:
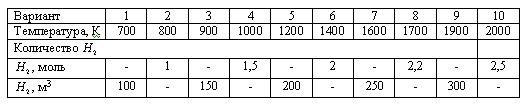
Температурная зависимость константы равновесия Кр, Па-0,5: lg(Kp) = -1190/T + 2,37
Скачать решение задачи 2.2-24 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-25 Газовую смесь, содержащую 20% объемных долей СО и 80% объемных долей N2, пропускают при температуре 1273 К и давлении 0,1 МПа над оксидом железа, который восстанавливается до железа по реакции
FеО + СО = Fе + СО2.
Найти состав равновесной смеси, объемные доли, %, и количество образовавшегося Fе, кг, если константа равновесия равна 0,403. Расчет вести на 1000 м3 исходного газа.
Скачать решение задачи 2.2-25 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-26 Для реакции конверсии оксида углерода CO + H2O ↔ H2 + CO2 температурная зависимость константы равновесия имеет вид:
lgKp700 = -2203,24/T + 5,1588*10-5*T+2,5426*10-7*T2 - 7,4617*1011*T3 - 2,3
Найти состав равновесной смеси при температуре 700 К, если в исходной смеси на 1 моль СО приходится 2,4 моль воды.
Скачать решение задачи 2.2-26 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-28 Зависимость константы равновесия Кр, Па-1, от температуры для реакции дегидрирования вторичного бутилового спирта
C2H5CHOHCH3 = C2H5COCH3 + H2
имеет вид
lgKp = -2790/T + 1,51*lgT+6,869
Найти состав в молярных долях, %, равновесной газофазной реакционной смеси при температуре 600 К и общем давлении 0,2 МПа. если исходная смесь состоит из 1 моль бутилового спирта и 1 моль водорода.
Скачать решение задачи 2.2-28 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-29 Обратимая реакция A + B = 2R с тепловым эффектом ΔН0 = -30,5 кДж/моль и энтропией S0 = -80 кДж/(кмоль•град.) протекает при температуре 298 К. Определить во сколько раз изменится значение равновесной степени превращения вещества А, если соотношение начальных концентраций реагентов А и В уменьшить от 0,5 до 0,25.
Скачать решение задачи 2.2-29 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.2-30 Дегидрирование этилбензола протекает при температуре 860 К и общем давлении 9,81*104 Па по реакции С6Н5С2Н5 = С6Н5С2Н3 + Н2. Для сдвига равновесия реакции вправо используют введение в исходную смесь инертного компонента (водяного пара). Определить, каким должно быть соотношение пар/этилбензол, чтобы равновесная степень превращения увеличилась на 20 % по сравнению со степенью равновесия, рассчитанной для стехиометрической смеси. Константа равновесия равна 5*104 Па-1.
Скачать решение задачи 2.2-30 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-1 При проведении жидкофазной реакции в реакторе были получены следующие опытные данные:
t, мин 10 30 60 80 100
х 0,31 0,674 0,874 0,95 0,977
Определить порядок реакции.
Скачать решение задачи 2.3-1 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-2 Дана реакция 2А + 3В = S + 4R + 2F. Определить скорость расходования компонента В и скорость образования продуктов реакции, если скорость исчезновения компонента А составляет 5 моль в единицу времени на единицу объема.
Скачать решение задачи 2.3-2 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-3 Составить кинетическую модель сложной реакции в которой все реакции протекают по механизму первого порядка.
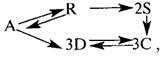
Скачать решение задачи 2.3-3 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-6. Определить энергию активации и предэкспоненциальный множитель в уравнении Аррениуса для константы скорости реакции, значения которой при температурах 273 и 293 К равны соответственно 2,46 и 47,5 с-1.
Скачать решение задачи 2.3-6 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-7. Определить энергию активации реакции, если при изменении температуры с 723 до 773 К ее скорость возрастает в 2,73 раза.
Скачать решение задачи 2.3-7 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-9 Для реакции n-го порядка экспериментально получена зависимость концентрации реагента от времени проведения реакции:
t, мин 0 1 2 3 4 5
С, кмоль/м3 2 0,96 0,63 0,47 0,39 0,31
Определить порядок реакции и вычислить константу скорости.
Скачать решение задачи 2.3-9 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-11 Для реакции второго порядка 2A → R + S определить степень превращения и скорость реакции через 10, 30 и 50 с. Константа скорости равна 0,02 м3(кмоль-с)-1, начальная концентрация вещества А = 2 кмоль/м3.
Скачать решение задачи 2.3-11 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-12 Для обратимой реакции 2А = R, протекающей в газовой фазе при постоянном давлении, выразить изменение степени превращения вещества ΔxA/Δt как функцию от степени превращения хА. Прямая реакция второго порядка, обратная - первого.
Скачать решение задачи 2.3-12 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-13 Выразить скорость обратимой реакции А ↔ 2R как функцию степени превращения. Реакция протекает в газовой фазе при постоянном давлении.
Скачать решение задачи 2.3-13 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-14 Выразить скорость необратимой реакции как функцию степени превращения исходных веществ для гомогенной реакции взаимодействия гидроксида натрия с этилацетатом.
NaOH + CH3COOC2H5 ↔ CH3COONa + C2H5OH
Скачать решение задачи 2.3-14 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-15 Для реакции «реагент А > продукты реакции» проводят два эксперимента и поучают следующие данные: Эксперимент 1: СА0 = 2000 моль/м3, при t0,5 = 1/8 ч СА = СА0/2.
Эксперимент 2: СА0 = 1000 моль/м3, при t0,5 = 1/2 ч СА = СА0/2.
Здесь t0,5 – время, за которое концентрация компонента А уменьшаются на половину. На основании этих данных определить порядок реакции.
Скачать решение задачи 2.3-15 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-17 Дана обратимая реакция Н2 + J2 ↔ 2HJ. Определить время, необходимое для образования 1 моль HJ в реакторе вместимостью 1 л при температуре 550 °С, если исходная смесь состоит из 2 моль водорода и 1 моль йода. При данной температуре константа скорости прямой реакции равна 1,25*10-4 л/(моль-с), а константа скорости обратной реакции - 0,25*10-4 л/(моль*с).
Скачать решение задачи 2.3-17 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-18 Для обратимой реакции эстерификации этилового спирта с концентрацией 56,5 % массовых долей с помощью муравьиной кислоты с концентрацией 0,07 моль/л k1 = 1,85*10-3 с-1 и k-1 = 1,85*10-3 с-1. Определить равновесную концентрацию муравьиной кислоты и время, необходимое для того, чтобы эстерификаця прошла на 90 %.
Скачать решение задачи 2.3-18 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-19. При температуре 230С исследуют кинетику реакции первого порядка изомеризации цис-2-бутена в транс-2-бутен хроматографическим анализом реакционной смеси. Получены следующие данные:
Время t,c 0 60 120 155 200
Транс-2-бутен, объемные доли, % 0 5,0 9,2 11 15
По приведенным значениям содержания в смеси транс-изомера можно допустить, что реакция является практически необратимой. какая будет при этом константа скорости реакции?
Через достаточно длительное время содержание в смеси транс-изомера составило 65,5% объемных долей. Рассматривая теперь эту реакцию как обратимую, найти новое значение константы скорости К1.
Скачать решение задачи 2.3-19 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-20 Для обратимой экзотермической реакции A = R + Qр зависимость константы равновесия от температуры задана в виде lnKp= 9000/T-27. Экспериментально установлено, что при температуре 30 °С за время 1140 с степень превращения вещества А хА = 0,79, при 40 °С за 480 с - хА = 0,65. Построить зависимость степени превращения вещества А от температуры и определить оптимальную температуру, при которой достигается максимальная степень превращения, если продолжительность реакции составляет 300 с
Скачать решение задачи 2.3-20 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-21 При постоянной температуре протекает параллельная реакция
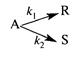
с константами скоростей k1 = 10-3 с-1 и k2 = 10-2 с-1. Перед началом реакции СА0 = 2 моль/м3, СR0 = СS0 = 0. Определить значение скорости превращения реагента А и продукта 5 в момент времени, когда СR = 0,05 кмоль/м3, СS = 0,5 кмоль/м3. Каким будет это время?
Скачать решение задачи 2.3-21 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-23 Для обратимой реакции A <=> R в начальный момент времени парциальное давление реагента А составляет 1,275*104 Па, а вещества R - 0. Через 10 мин парциальное давление реагента А стало 5,2*103 Па, а вещества R = 7,554*103 Па. Рассчитать парциальное давление реагента А через 20 и 40 мин, если отношение k1/k-1 = 3.
Скачать решение задачи 2.3-23 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-25. Параллельную реакцию
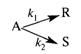
можно осуществить в диапазоне температур от 500 до 700 К. При какой температуре должна протекать реакция, чтобы обеспечить образование максимального количества продукта R, если константы скоростей, с-1, описываются уравнениями k1 = 1015 ехр[-20000/(R*Т)], k2 = 1014 ехр[-10000/(R*Т)]? Ответ обосновать
Скачать решение задачи 2.3-25 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-26 При высокой температуре уксусная кислота разлагается по двум направлениям:
СН3СООН → СН4 + СО2 (1)
СН3СООН → СН2СО + Н2О (2)
Константа скорости реакции и энергия активации реакции (1) при температуре 1189 К равны соответственно 3,74 с-1 и 155000 Дж/моль; для реакции (2) соответственно 4,65 с-1 и 184000 Дж/моль. Рассчитать время, необходимое для того, чтобы уксусная кислота прореагировала на 99 % и максимальный выход кетена.
Скачать решение задачи 2.3-26 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-27 Хлорирование метилбензола дает смесь пара- и орто-изомеров в соответствии с реакционной схемой
С6Н5СН3 + Cl2 → р-С6Н4С12 + HCl
С6Н5СН3 + Cl2 → о-С6Н4С12 + НС1.
Экспериментально получены следующие результаты:

Учитывая, что обе реакции первого порядка, определить их константы.
Скачать решение задачи 2.3-27 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-29 Протекает последовательная реакция первого порядка А→R→S. Концентрация промежуточного продукта достигает максимального значения через 170 мин. Рассчитайте константы скоростей этих реакций, если хА = 0,4.
Скачать решение задачи 2.3-29 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-30 Для последовательной реакции первого порядка А → R → S рассчитайте CRmax, если: 1) k1 >> k2; 2) k1 = k2; 3) k1 << k2.
Скачать решение задачи 2.3-30 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-31 Протекает последовательная реакция первого порядка А→R→S. Максимальная концентрация продукта R при температуре 250 °С составляет 0,57 СA0. При какой температуре следует проводить реакции, чтобы CRMAX> СA0? Энергия активации целевой реакции равна 48000 Дж/моль, побочной - 39000 Дж/моль. При этом предэкспоненциальные множители в выражениях для констант скоростей обеих реакций примерно равны.
Скачать решение задачи 2.3-31 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-32 Проводится реакция А+В=R с константой скорости k=1*102 л/(моль*ч). Исходные концентрации веществ А и В равны по 0,08 моль/л. Найти время, необходимое для снижения концентрации веществ до 0,04 моль/л.
Скачать решение задачи 2.3-32 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-33 Газофазная реакция А → R + S проводится при постоянном давлении и постоянной температуре. В исходной смеси содержится 100% вещества А. Равновесная степень превращения составляет 0,6. Как увеличить степень превращения до 0,8, не меняя давления и температуры?
Скачать решение задачи 2.3-33 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-34 Для параллельной реакции:
A -k1→ 2R
A -k2→ 3S
с константами скоростей k1 = 10-2 с-1 и k2 = 10-3 c-1 определить время, при котором в продуктах будет содержаться 0,8 кмоль/м3 вещества R, концентрацию вещества S и степень превращения вещества А. Перед началом реакции концентрация вещества А была 1,4 кмоль/м3, а вещества R и S отсутствовали.
Скачать решение задачи 2.3-34 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-35 Две параллельные реакции
a1A + b1B = rR + sS (целевая реакция)
a2A + b2B = yY + zZ (побочная реакция)
характеризуются кинетическими уравнениями
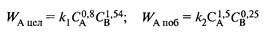
и энергиями активации Е1 = 45 кДж/моль, E2 = 65 кДж/моль. Проанализируйте зависимость дифференциальной селективности для такой системы реакций от: а) концентрации реагентов А и В; б) температуры. Какие можно дать рекомендации по выбору технологического режима для этого процесса?
Скачать решение задачи 2.3-35 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-37 При проведении последовательной реакции типа А → R → S в изотермических условиях степень превращения реагента составила 0,9. Определить дифференциальную и интегральную селективности по целевому продукту R, если k1 = 0,2 с-1, k2 = 0,1 с-1.
Скачать решение задачи 2.3-37 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.3-38 Реакция A + B = R + S проводится при температуре 507 К и начальной концентрации вещества А 0,05 кмоль/м3 в течение 40 мин. Константа скорости реакции равна 1,28 м3/(кмоль•мин). Оценить количественно влияние начального мольного соотношения реагентов (СА0:СВ0 = 2:1; СА0:СВ0 = 1:1; СА0:СВ0 = 1:1,5; СА0:СВ0 = 1:2) на достигаемую степень превращения вещества А.
Скачать решение задачи 2.3-38 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-1 Горение жидкого топлива протекает во внешнедиф-фузионной области. Топливо впрыскивается в камеру сгорания, образуя капли диаметром 0,1 мм, летящие со скоростью 1,5 м/с. Известно, что капля топлива диаметром 0,3 мм полностью сгорает в потоке такой же скорости за 2 с. Какова длина участка пламени, в котором полностью сгорает топливо?
Скачать решение задачи 2.4-1 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-2 Гранулированный колчедан подается в печь обжига с движущимся слоем колчедана. Фракционный состав колчедана следующий: 10 % массовых долей частиц с R0 = 3 мм; 20 % массовых долей частиц с R0 = 4 мм; 70 % массовых долей частиц с R0 = 6 мм. Среднее время пребывания частиц в зоне реактора равно 6 мин. Время полного сгорания частиц равно соответственно 3,5 мин, 5 и 8 мин.
Определить среднюю степень превращения колчедана, если процесс лимитируется:
1) химической реакцией;
2) внешней диффузией;
3) внутренней диффузией.
Скачать решение задачи 2.4-2 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-3 Обжиг ZnS проводится в наклонном вращающемся трубчатом реакторе. Частицы твердого вещества движутся в реакторе со скоростью 10 см/с. Известно, что при данных условиях за 1 мин степень превращения ZnS составляет 70 %. Определить длину реактора, обеспечивающую 95%-ную степень превращения исходного сырья, если обжиг проводится в кинетической области.
Скачать решение задачи 2.4-3 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-5 Гетерогенный процесс описывается реакцией Аг + Вт = Rт + Sг, в котором твердые частицы размером 6 мм за 10 мин реагируют на 95 %. Процесс лимитируется внутренней диффузией.
Определить время той же степени превращения для частиц размером 10 мм.
Скачать решение задачи 2.4-5 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-6 Твердые частицы размером 6 мм реагируют по реакции Аг + Втв = Rтв + Sг в потоке газа за 400 с на 90 %. Процесс протекает в кинетической области.
Определить среднюю степень превращения твердого вещества за 360 с, если гранулометрический состав смеси следующий: 15 % - частицы размером 2 мм, 60 % - частицы размером 3 мм, 25 % - частицы размером 4 мм.
Скачать решение задачи 2.4-6 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-7 Гетерогенный процесс описывается реакцией Аг + Вт = Rт +Sг и лимитируется внешнедиффузионной областью. Твердые частицы размером 10 мм полностью реагируют за 15 мин. За время пребывания твердая часть реагирует на 80 %. При переводе процесса в кинетическую область время полного превращения частиц твердого вещества становится равным 12 мин, а при переводе его во внешнедиффузионную область - 10 мин.
Определить степень превращения твердого вещества в кинетической и внешнедиффузионной областях за аналогичное время пребывания.
Скачать решение задачи 2.4-7 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-8 Обжиг ZnS проводится в наклонном вращающемся трубчатом реакторе. Частицы твердого вещества движутся в реакторе со скоростью 10 см/с. Известно, что при данных условиях за 1 мин степень превращения ZnS составляет 70%.Определить длину реактора, обеспечивающую 95%-ную степень превращения исходного сырья, если обжиг проводится во внешнедиффузионной области.
Скачать решение задачи 2.4-8 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-9 Обжиг ZnS проводится в наклонном вращающемся трубчатом реакторе. Частицы твердого вещества движутся в реакторе со скоростью 10 см/с. Известно, что при данных условиях за 1 мин степень превращения ZnS составляет 70%.
Определить длину реактора, обеспечивающую 95%-ную степень превращения исходного сырья, если обжиг проводится в внутридиффузионной области.
Скачать решение задачи 2.4-9 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-10 В реакторе с кипящим слоем осуществляется восстановление CO2 на углероде. В реактор непрерывно подается свежий углерод, так чтобы объем твердого вещества оставался постоянным и равным 0,1 м3. За 10 мин реакции размер частиц уменьшается в 2 раза.
Определить степень превращения по углероду на данный момент времени, время полного превращения углерода и среднюю массовую скорость подачи углерода в реактор, если насыпная плотность углерода 480 кг/м3.
Скачать решение задачи 2.4-10 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-11 Гетерогенный процесс описывается реакцией A(Г) + B(ТВ) = R(Г) + S(ТВ), в котором твердые частицы размером 12 мм за 20 мин реагируют на 75% при лимитирующей стадии внутренней диффузии. На сколько сократится время пребывания в зоне реакции той же степени превращения, если размер частиц уменьшить в 2 раза?
Скачать решение задачи 2.4-11 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-12 Твердые частицы размером 6 мм реагируют по реакции Аг + Вт = Rт +Sг в потоке газа за 400 с на 80 %. Процесс протекает во внешнедиффузионной области.
Какое должно быть время пребывания вещества для достижения 90 %-ной степени превращения по твердому веществу, если гранулометрический состав твердой смеси следующий: 40 % - частицы размером 2 мм, 50 % - частицы размером 4 мм и 10 % - частицы размером 6 мм?
Скачать решение задачи 2.4-12 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-13 Гетерогенный процесс описывается реакцией AГ + BТВ = RГ в котором твердые частицы размером 6 мм имеют степень превращения 95%. Константа скорости реакции - 0,8 см/с, а коэффициент массоотдачи - 0,3 см/с. Концентрация реагента А в газовом потоке - 0,02 моль/л.
Рассчитать скорость превращения газового реагента, отнесенную к единице объема твердой фазы при заданной хтв.
Скачать решение задачи 2.4-13 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.4-15. В реакторе осуществляется гетерогенный процесс, описываемый реакцией Aж + Bтв → RГ, в котором твердые частицы размером 10 мм имеют степень превращения 90%. Константа скорости реакции - 0,6 см/с, коэффициент массоотдачи - 0,4 см/с. В качестве жидкой фазы используется серная кислота 80%-ной концентрации, а в качестве твердой фазы - железо, плотность которого равна 7 г/см3. Концентрация СA0 = 0,015 моль/л, СB0 = 0,125 моль/л.
Рассчитать наблюдаемую скорость процесса, отнесенную к единице объема твердой фазы, если время пребывания частиц в зоне реакции равно 20 мин.
Скачать решение задачи 2.4-15 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.5-1 Рассчитать и построить зависимость степени использования внутренней поверхности катализатора от модуля Зельковича-Тилле.
Скачать решение задачи 2.5-1 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.5-2 Степень использования внутренней поверхности катализатора равна 0,7. Размер пластинчатого зерна катализатора составляет 6 мм.
Определить эффективный коэффициент диффузии и область протекания процесса при проведении каталитической реакции типа A -> R с константой скорости 0,12 с-1.
Скачать решение задачи 2.5-2 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.5-3 Каталитическая реакция типа A = R проводится на пластинчатых зернах катализатора размером 3 мм. Константа скорости равна 1,85 с-1. Эффективный коэффициент диффузии составляет 0,06 см2/с.Определить степень использования внутренней поверхности катализатора и область протекания процесса.
Скачать решение задачи 2.5-3 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.5-4 Как изменится скорость каталитического процесса и степень использования внутренней поверхности пористого катализатора в виде пластин размером 2R0 = 5 мм, если понизить температуру с 560 до 500 К? Реакция первого порядка с константой скорости, с-1, определяемой уравнением k = 3,5•106exp(-7600/T). Эффективный коэффициент диффузии остается неизменным и равным 0,7 см2/с.
Скачать решение задачи 2.5-4 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.5-5 Проводится реакция первого порядка на пористом катализаторе пластинчатого типа с толщиной пластины 4 мм. Константа скорости равна 0,3 с-1. Эффективный коэффициент диффузии составляет 0,5 см2/с. Как изменится наблюдаемая скорость процесса и степень использования внутренней поверхности катализатора, если взять катализатор с толщиной пластинки 6 мм?
Скачать решение задачи 2.5-5 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.5-6 Как изменится скорость каталитического процесса и степень использования внутренней поверхности пористого катализатора в виде пластин размером 2R0 = 5 мм, если понизить температуру с 560 до 500 К? Реакция первого порядка с константой скорости, с-1, определяемой уравнением k = 3,5•106exp(-7600/T). Эффективный коэффициент диффузии остается неизменным и равным 0,7 см2/с.
Скачать решение задачи 2.5-6 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.5-7 Как изменится наблюдаемая скорость каталитического процесса и степень использования внутренней поверхности сферического катализатора радиусом 8 мм, если температуру изменить с 559 К до 653 К? Реакция первого порядка. Константа скорости, с-1, определяется уравнением k = 4,2*106exp(-8200/T). Эффективный коэффициент диффузии равен 0,6 см2/с и не зависит от температуры.
Скачать решение задачи 2.5-7 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.5-8 Определить изменение степени использования внутренней поверхности пористого катализатора и скорости реакции при проведении реакции первого порядка типа A → R при изменении температуры с 700 до 600 К и его формы с пластинчатой (2R0 = 4 мм) на таблетированную (2R0 = 4 мм, H= 1/3*D). Эффективный коэффициент диффузии равен 0,02 см2/с, константа скорости реакции при температуре 810 К составляет 3,2 с-1, энергия активации данной реакции -36700 Дж/моль.
Скачать решение задачи 2.5-8 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.5-9 Определить изменение степени использования внутренней поверхности пористого катализатора и скорости реакции при проведении реакции первого порядка А → R, если сферический катализатор диаметром 6 мм заменить пластинчатым с размером пластины 2R0 = 4 мм. Эффективный коэффициент диффузии равен 0,3 см2/с, константа скорости реакции при температуре 700 К составляет 0,82 с-1.
Скачать решение задачи 2.5-9 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.5-10 Определить изменение степени использования внутренней поверхности пористого катализатора и скорости реакции при проведении реакции первого порядка типа А -> R на сферическом катализаторе диаметром 6 мм при изменении температуры с 603 до 703 К. Эффективный коэффициент диффузии равен 0,09 см2/с, константа скорости реакции при температуре 653 К составляет 1,52 с-1, энергия активации данной реакции - 56,56 кДж/моль.
Скачать решение задачи 2.5-10 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Задача 2.5-12 На непористом катализаторе протекает реакция первого порядка. Константа скорости, отнесенная к единице объема катализатора, при температуре 500 К равна 1,5 с-1. Энергия активации реакции составляет 84 кДж/моль. Коэффициент массоотдачи из потока газовой фазы к поверхности катализатора равен 2,5 м/с и не зависит от температуры.
Построить зависимость lnkН = f(1/T) в интервале температур 450 - 800 К, определить область протекания процесса и как будет изменятся наблюдаемая энергия активации данной реакции.
Скачать решение задачи 2.5-12 (В.И. Игнатенков, В.С Бесков) (цена 200р)
Cтраница 1 из 2


